近段時(shí)間,信達(dá)生物研發(fā)動(dòng)態(tài)頻發(fā):PI3Kδ抑制劑帕薩利司申報(bào)上市、ADC新藥IBI343啟動(dòng)I期臨床......目前信達(dá)生物有37款新藥(34款1類新藥)處于獲批臨床及以上階段,11款1類新藥領(lǐng)跑雙抗黃金賽道,CAR-T產(chǎn)品上市在即,首款自主研發(fā)的ADC藥物亮相。非1類新藥中,3個(gè)重磅單抗緊盯$90億市場(chǎng)。
信達(dá)生物是國(guó)內(nèi)為數(shù)不多的具有自主造血能力的創(chuàng)新藥企。據(jù)公司公告,2022年前三季度信達(dá)生物總產(chǎn)品收入超過(guò)30億元。目前信達(dá)生物已有8款產(chǎn)品獲批,公司預(yù)計(jì)在未來(lái)4-5年內(nèi)營(yíng)業(yè)收入達(dá)到200億元。
日前,2022年全國(guó)醫(yī)保目錄調(diào)整工作落下帷幕,信達(dá)生物有5款產(chǎn)品(含新增適應(yīng)癥)成功納入新版全國(guó)醫(yī)保目錄,其中信迪利單抗在原基礎(chǔ)上新增兩項(xiàng)適應(yīng)癥(胃癌和食管癌),成為唯一將五大高發(fā)瘤種一線治療納入國(guó)家醫(yī)保的PD-1;奧雷巴替尼通過(guò)談判首次納入國(guó)家醫(yī)保目錄,填補(bǔ)了攜T315I突變CML患者治療的空白;貝伐珠單抗、利妥昔單抗、阿達(dá)木單抗新增多項(xiàng)適應(yīng)癥,受益患者群體不斷擴(kuò)大。
11款1類新藥領(lǐng)跑雙抗黃金賽道
雙抗藥物通過(guò)細(xì)胞融合、重組DNA、蛋白質(zhì)工程等技術(shù)制備,同時(shí)或先后特異性結(jié)合2種抗原或同一抗原的兩個(gè)不同表位,理論上可以發(fā)揮“1+1>2”的作用,逐漸成為創(chuàng)新藥研發(fā)和投資的“新寵”。
目前已有超30家國(guó)內(nèi)藥企布局雙抗藥物研發(fā),其中信達(dá)生物為領(lǐng)跑者,有11款1類新藥處于I期臨床及以上階段,涉及PD-(L)1、CD47、HER2、Claudin18.2、TIGIT等熱門(mén)靶點(diǎn),適應(yīng)癥集中在抗腫瘤及眼科領(lǐng)域。
信達(dá)生物國(guó)內(nèi)在研雙抗
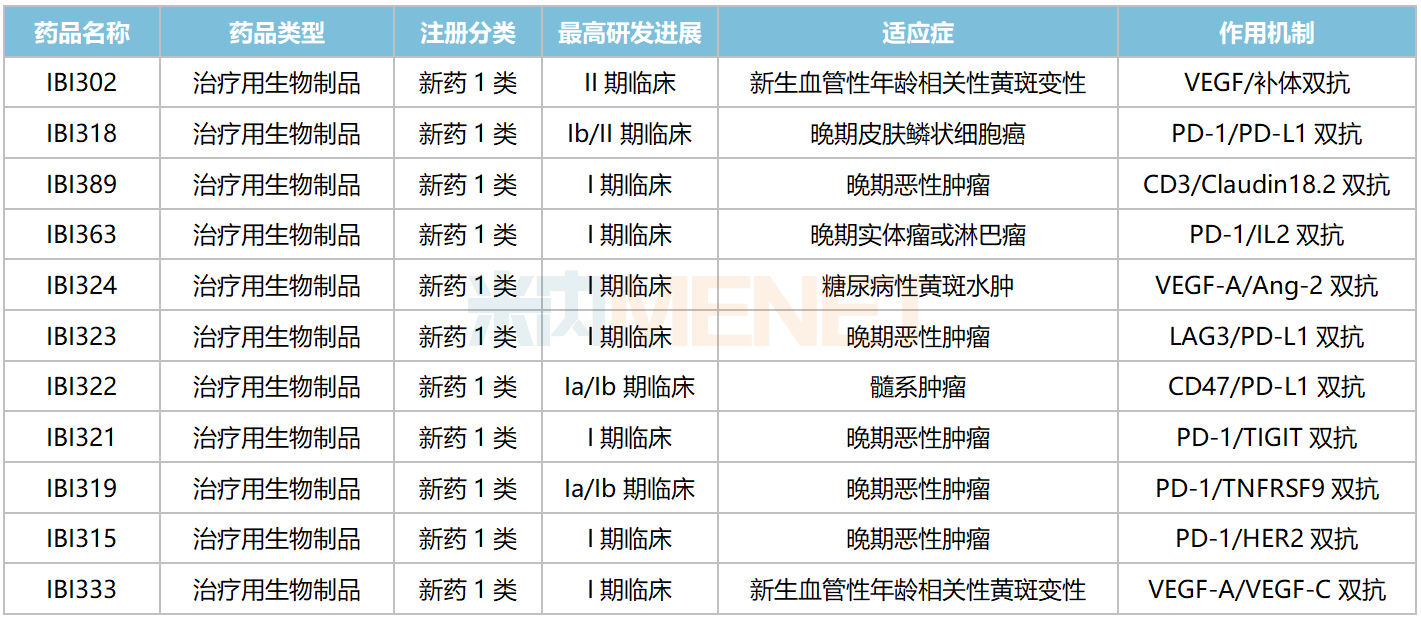
來(lái)源:米內(nèi)網(wǎng)中國(guó)臨床試驗(yàn)數(shù)據(jù)庫(kù)
信達(dá)生物在研雙抗在國(guó)內(nèi)均無(wú)同類產(chǎn)品獲批上市,PD-1/PD-L1雙抗IBI318、VEGF/補(bǔ)體雙抗IBI302均已步入II期(含Ib/II期)臨床,分別用于治療晚期皮膚鱗狀細(xì)胞癌、新生血管性年齡相關(guān)性黃斑變性。
米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前全球有9款雙抗藥物獲批上市,2021年全球合計(jì)銷售規(guī)模接近40億美元,其中羅氏的艾美賽珠單抗以30.22億瑞士法郎的銷售額一騎絕塵。有數(shù)據(jù)預(yù)測(cè)顯示,隨著越來(lái)越多的創(chuàng)新雙抗進(jìn)入市場(chǎng),同時(shí)已上市雙抗獲批更多適應(yīng)癥,雙抗的全球市場(chǎng)規(guī)模在2025年將超過(guò)500億元。
全球已獲批上市的雙抗藥物
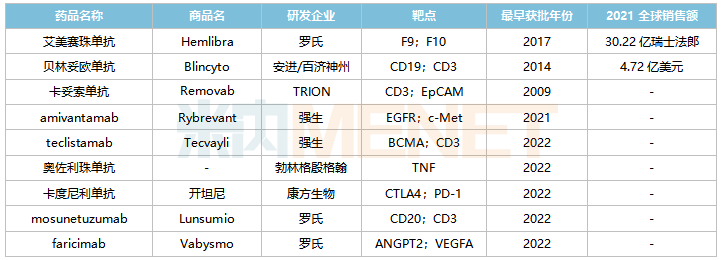
來(lái)源:米內(nèi)網(wǎng)綜合數(shù)據(jù)庫(kù)
目前羅氏的艾美賽珠單抗(2018/11)、安進(jìn)/百濟(jì)神州的貝林妥歐單抗(2020/11)及康方生物的卡度尼利單抗(2022/6)已在國(guó)內(nèi)獲批,其中艾美賽珠單抗、貝林妥歐單抗2021年在中國(guó)三大終端6大市場(chǎng)(統(tǒng)計(jì)范圍詳見(jiàn)本文末)的銷售額增速分別達(dá)13.7%、187.6%。
CAR-T產(chǎn)品上市可期
嵌合抗原受體T細(xì)胞免疫療法(CAR-T療法)是一種治療腫瘤的新型精準(zhǔn)靶向療法,由于療效數(shù)據(jù)優(yōu)異,甚至能“治愈”癌癥,一躍成為資本關(guān)注的焦點(diǎn)。
目前信達(dá)生物已有2款CAR-T產(chǎn)品步入臨床階段,其中與馴鹿生物合作開(kāi)發(fā)的伊基侖賽注射液(IBI326)已提交上市申請(qǐng),這是國(guó)內(nèi)第一款全流程自主研發(fā)的CAR-T產(chǎn)品,也是國(guó)內(nèi)首家報(bào)產(chǎn)的靶向BCMA的CAR-T產(chǎn)品。
信達(dá)生物在研的CAR-T產(chǎn)品
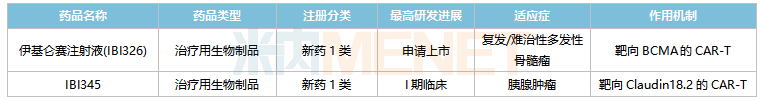
來(lái)源:米內(nèi)網(wǎng)中國(guó)臨床試驗(yàn)數(shù)據(jù)庫(kù)
米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前全球有8款CAR-T產(chǎn)品獲批上市,2021全球合計(jì)銷售規(guī)模超過(guò)17億美元,其中有6款CAR-T產(chǎn)品靶向CD19,該類產(chǎn)品的混戰(zhàn)正在持續(xù)加劇。
全球已獲批上市的CAR-T產(chǎn)品
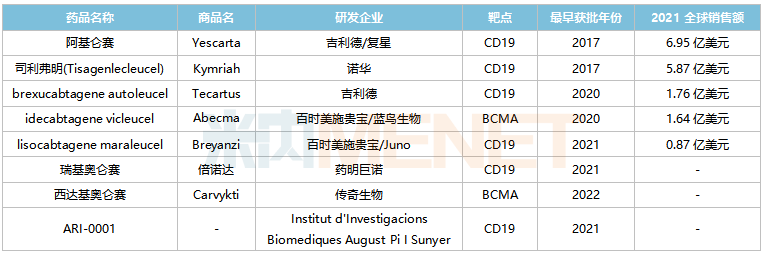
來(lái)源:米內(nèi)網(wǎng)綜合數(shù)據(jù)庫(kù)
國(guó)內(nèi)已獲批的CAR-T產(chǎn)品包括吉利德/復(fù)星的阿基侖賽(2021/6)、藥明巨諾的瑞基奧侖賽(2021/9),其中阿基侖賽預(yù)計(jì)2022E在中國(guó)城市實(shí)體藥店終端的銷售額將突破2億元。根據(jù)弗若斯特沙利文的資料,預(yù)計(jì)2021-2025年,中國(guó)CAR-T療法市場(chǎng)規(guī)模(以成本價(jià)計(jì))復(fù)合年增長(zhǎng)率將超過(guò)150%。伴隨更多產(chǎn)品的獲批,預(yù)計(jì)2030年將達(dá)到289億元。
首款自主研發(fā)ADC新藥亮相
抗體偶聯(lián)藥物(ADC)由抗體、連接子和毒素三部分偶聯(lián)而成,通過(guò)多樣“組合”迭代出新的產(chǎn)品。正因?yàn)槿绱?,ADC藥物有“生物導(dǎo)彈”之稱,被業(yè)界認(rèn)為或?qū)⒊蔀橄乱粋€(gè)平臺(tái)級(jí)產(chǎn)品。
2022年8月,信達(dá)生物與賽諾菲達(dá)成多項(xiàng)目合作與許可協(xié)議,以開(kāi)展兩款高潛力抗腫瘤藥物SAR408701(CEACAM5 ADC)及SAR444245(非α偏向性IL-2)在中國(guó)的臨床開(kāi)發(fā)及商業(yè)化。
目前SAR408701注射液(IBI126)已在國(guó)內(nèi)開(kāi)展III期臨床,用于治療轉(zhuǎn)移性非鱗狀非小細(xì)胞肺癌。這是一款靶向CEACAM5的ADC藥物,國(guó)內(nèi)暫無(wú)同類藥物獲批,IBI126研發(fā)進(jìn)展最快。
2022年10月,信達(dá)生物以新藥1類提交的IBI343臨床申請(qǐng)獲得CDE承辦受理,2022年底獲批臨床,日前已啟動(dòng)I期臨床。這是信達(dá)生物自主研發(fā)的首款A(yù)DC藥物,以claudin18.2(CLDN18.2)為靶點(diǎn),該靶點(diǎn)已成為全球藥企競(jìng)相布局的熱門(mén)靶點(diǎn)。
信達(dá)生物國(guó)內(nèi)在研的ADC藥物
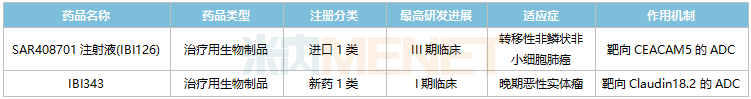
來(lái)源:米內(nèi)網(wǎng)中國(guó)臨床試驗(yàn)數(shù)據(jù)庫(kù)
米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前全球有16款A(yù)DC藥物(不含生物類似藥)獲批上市,2021全球合計(jì)銷售規(guī)模超過(guò)52億美元。根據(jù)Natrue子刊的市場(chǎng)預(yù)測(cè),2026年全球ADC藥物市場(chǎng)規(guī)模將達(dá)到164億美元。
全球已獲批上市的ADC藥物
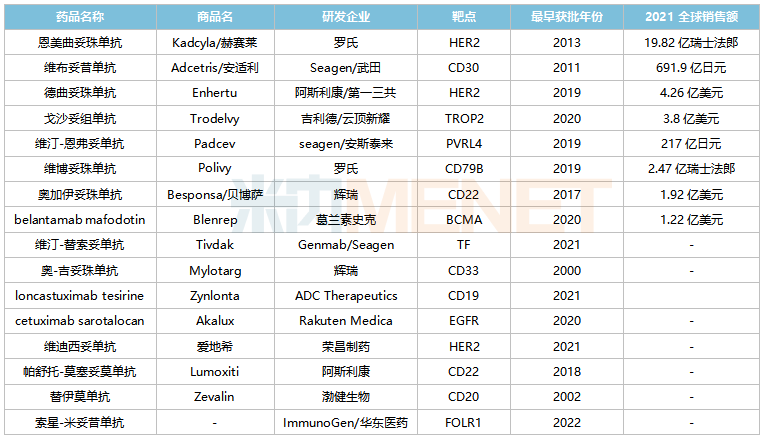
來(lái)源:米內(nèi)網(wǎng)綜合數(shù)據(jù)庫(kù)
而在國(guó)內(nèi)市場(chǎng),已有多款A(yù)DC藥物獲批上市,包括輝瑞的奧加伊妥珠單抗(2021)、羅氏的恩美曲妥珠單抗(2020)、武田的維布妥昔單抗(2020)、吉利德/云頂新耀的戈沙妥組單抗(2022)及榮昌生物的維迪西妥單抗(2021),其中恩美曲妥珠單抗、維布妥昔單抗2021年在中國(guó)三大終端6大市場(chǎng)銷售額分別接近3億元及超過(guò)1億元,增長(zhǎng)率分別為102.9%、210.8%。
3個(gè)重磅單抗緊盯$90億市場(chǎng)
除了1類新藥,信達(dá)生物也布局改良新藥及生物類似藥。
目前信達(dá)生物已有3款生物類似藥獲批上市,分別為貝伐珠單抗、阿達(dá)木單抗及利妥昔單抗,3款產(chǎn)品在2021年中國(guó)三大終端6大市場(chǎng)合計(jì)銷售規(guī)模接近150億元。
信達(dá)生物國(guó)內(nèi)在研的非1類新藥
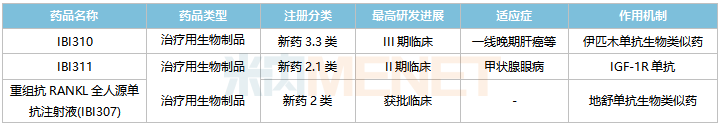
來(lái)源:米內(nèi)網(wǎng)中國(guó)臨床試驗(yàn)數(shù)據(jù)庫(kù)
3款重磅單抗在國(guó)內(nèi)處于獲批臨床及以上階段。正在開(kāi)展III期臨床的IBI310為抗CTLA-4單抗,是伊匹木單抗生物類似藥,原研產(chǎn)品2021年全球銷售額達(dá)20.26億美元;正在開(kāi)展I期臨床的IBI311屬于IGF-1R單抗,原研產(chǎn)品為T(mén)epezza,2021年全球銷售額達(dá)16.6億美元;已獲批臨床的重組抗RANKL全人源單抗注射液(IBI307)為地舒單抗生物類似藥,原研產(chǎn)品2021年全球銷售額超過(guò)50億美元。
信達(dá)生物國(guó)內(nèi)在研新藥
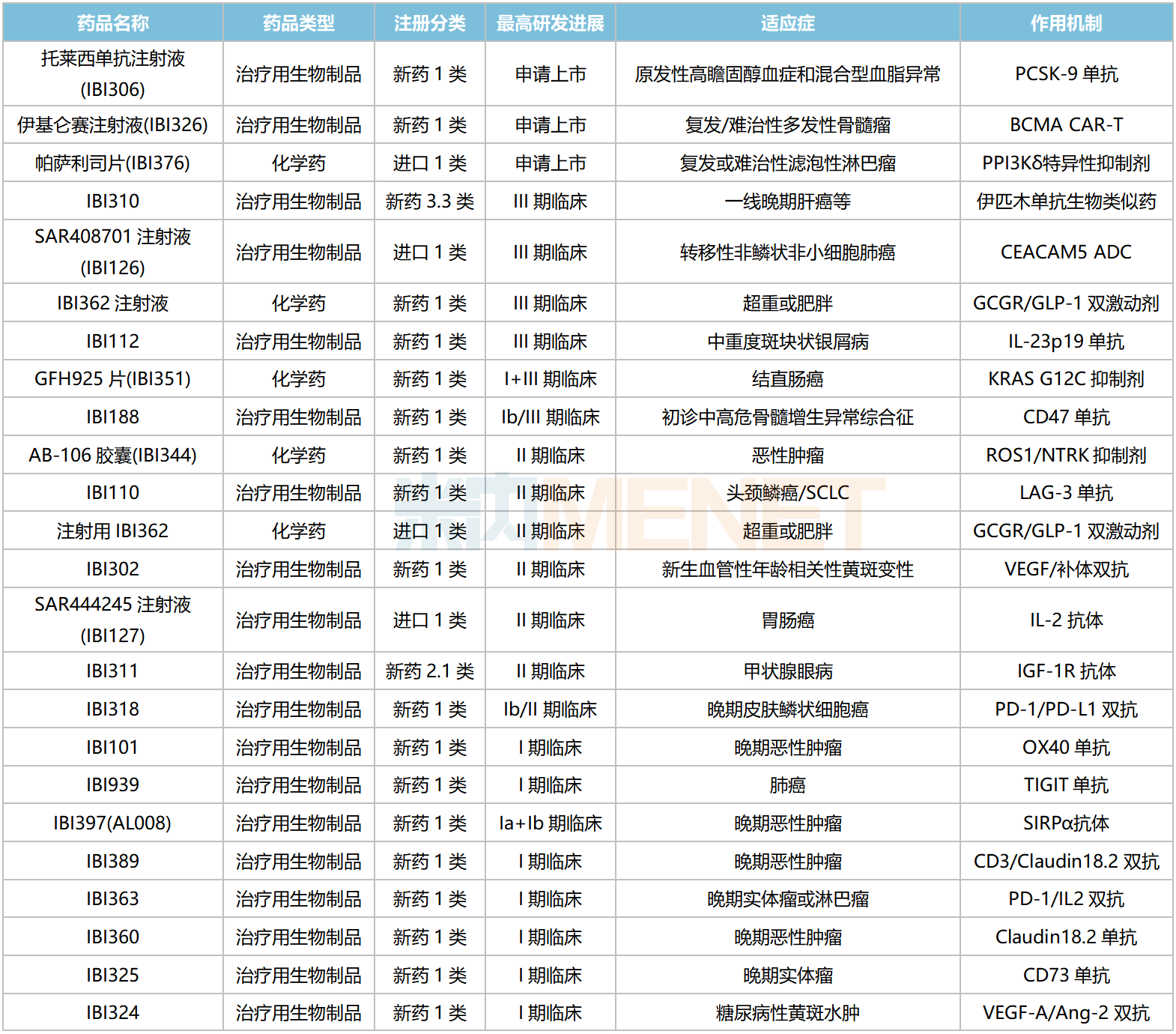
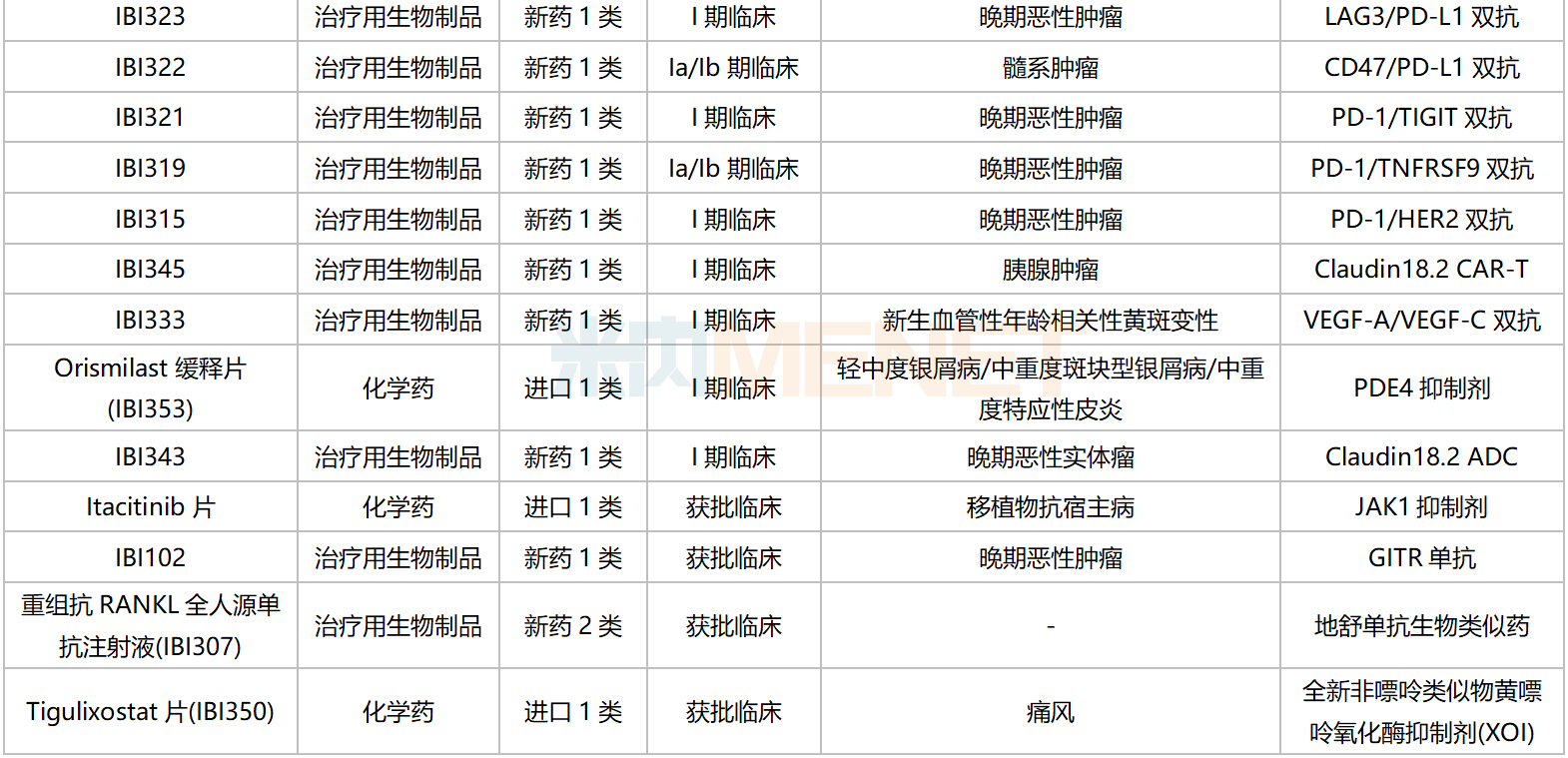
資料來(lái)源:米內(nèi)網(wǎng)數(shù)據(jù)庫(kù)等
注:米內(nèi)網(wǎng)《中國(guó)三大終端6大市場(chǎng)藥品競(jìng)爭(zhēng)格局》,統(tǒng)計(jì)范圍是:城市公立醫(yī)院和縣級(jí)公立醫(yī)院、城市社區(qū)中心和鄉(xiāng)鎮(zhèn)衛(wèi)生院、城市實(shí)體藥店和網(wǎng)上藥店,不含民營(yíng)醫(yī)院、私人診所、村衛(wèi)生室,不含縣鄉(xiāng)村藥店;上述銷售額以產(chǎn)品在終端的平均零售價(jià)計(jì)算。數(shù)據(jù)統(tǒng)計(jì)截至2月1日,如有疏漏,歡迎指正!

