中國(guó)醫(yī)藥化工網(wǎng)10月26日訊 分析2000年至2014年FDA優(yōu)先審評(píng)品種,優(yōu)先審評(píng)究竟有何益處?截至2015年9月中旬,我國(guó)有數(shù)以千計(jì)的申請(qǐng)獲得特殊審批資格,但特殊審批之于暢銷(xiāo)藥,又有多大的相關(guān)性?
美國(guó)是全球創(chuàng)新能力最強(qiáng)的國(guó)家,很多人都將這一現(xiàn)象歸結(jié)于其制度、人才培養(yǎng)、知識(shí)產(chǎn)權(quán)保護(hù)以及強(qiáng)大的經(jīng)濟(jì)基礎(chǔ)支撐等方面的優(yōu)越性,還有美國(guó)國(guó)內(nèi)龐大而靈活的私人及企業(yè)科技研發(fā)機(jī)構(gòu),帶動(dòng)了整個(gè)國(guó)家科技的蓬勃發(fā)展。在藥物創(chuàng)新研發(fā)方面,美國(guó)也長(zhǎng)期引導(dǎo)全球潮流,原因一是美國(guó)人骨子里非常崇尚的創(chuàng)新精神,二是政策方面也為發(fā)明和創(chuàng)造者提供了適宜的環(huán)境。
為了研制出能夠戰(zhàn)勝疾病的新藥,不計(jì)其數(shù)的科學(xué)工作者耗費(fèi)數(shù)年到數(shù)十年的時(shí)間在各自崗位辛勤工作,由此源源不斷的新藥注冊(cè)申請(qǐng)送到了FDA手中。為加快藥品審查,從1992年開(kāi)始,F(xiàn)DA創(chuàng)建了審查時(shí)間兩級(jí)系統(tǒng)(標(biāo)準(zhǔn)審評(píng)和優(yōu)先審評(píng))——優(yōu)先審評(píng)(Priority Review)的周期為6個(gè)月,標(biāo)準(zhǔn)審評(píng)周期為10個(gè)月。通過(guò)增加人力物力的投入,優(yōu)先審評(píng)類(lèi)藥物審評(píng)的速度得以提高。
要想獲得優(yōu)先審評(píng)資質(zhì)的認(rèn)定,申報(bào)的產(chǎn)品必須在安全性和有效性上產(chǎn)生顯著改善或具有優(yōu)于現(xiàn)有治療手段的潛力,更方便或適用于更廣泛的人群。與加速審批等不同,優(yōu)先審評(píng)的特點(diǎn)只針對(duì)審評(píng)階段,它既不改變審評(píng)標(biāo)準(zhǔn),也不加速臨床試驗(yàn)進(jìn)程。但是,新藥進(jìn)入市場(chǎng)的時(shí)間縮短了,利于企業(yè)更快收回投資。
曾有研究數(shù)據(jù)顯示,創(chuàng)新性程度越高的藥品,取得的經(jīng)濟(jì)回報(bào)也越大。回望2000年至2014年FDA優(yōu)先審評(píng)品種,哪些產(chǎn)品獲得了巨大經(jīng)濟(jì)回報(bào)?而對(duì)于那些熟悉的暢銷(xiāo)藥物,優(yōu)先審評(píng)有何益處值得考究。
美國(guó):優(yōu)先審評(píng)藥未必暢銷(xiāo)
暢銷(xiāo)藥的成因主要是藥物特性、市場(chǎng)規(guī)律、企業(yè)營(yíng)銷(xiāo)實(shí)力及專(zhuān)利等,優(yōu)先審評(píng)資格非主因
2000~2014年,共有301個(gè)品種獲得FDA的優(yōu)先審評(píng)資質(zhì),其中2014年獲批最多,為37個(gè),而排第二位的年份要追溯到2004年的29個(gè);獲批最少的是2001年,只有10個(gè)。
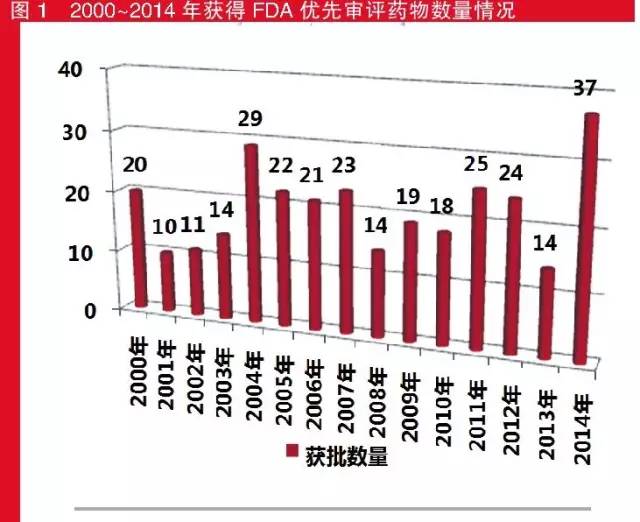
值得注意的是,在2006年至2008年間,由于艾滋病的泛濫,F(xiàn)DA臨時(shí)性?xún)?yōu)先審評(píng)批準(zhǔn)了20個(gè)治療此類(lèi)疾病的藥物。
在獲得優(yōu)先審評(píng)資質(zhì)的藥物中,新分子實(shí)體(NME)占據(jù)了半壁江山。
既獲得優(yōu)先審評(píng)又獲得孤兒藥稱(chēng)號(hào)的“雙獲”藥物則是另一個(gè)值得關(guān)注的現(xiàn)象。從數(shù)量上看,優(yōu)先審評(píng)藥物中新分子實(shí)體和獲得孤兒藥稱(chēng)號(hào)數(shù)量最多的年份均為2014年,分別為19個(gè)和18個(gè);而從占比來(lái)看,新分子實(shí)體數(shù)量占比最高的是2001年,孤兒藥占比最高的是2014年。15年間,有7個(gè)年份的NME獲批數(shù)量的占比超過(guò)了五成,獲孤兒藥稱(chēng)號(hào)的藥物的占比在2014年也接近50%,且近幾年(2013年除外)這種“雙獲”藥物的數(shù)量均超過(guò)了兩位數(shù)。

追蹤近些年來(lái)受市場(chǎng)追捧的超級(jí)暢銷(xiāo)藥可以發(fā)現(xiàn),雖然有近三成的藥物獲得了優(yōu)先審評(píng)資格,但超級(jí)暢銷(xiāo)藥最顯著的特點(diǎn)卻不是優(yōu)先審批資格,而是它們的身份大多是新分子實(shí)體和新生物藥,且大多屬于制藥巨頭。



 110102000668(1)號(hào)
110102000668(1)號(hào)