9月9日訊 近日,江西省藥監(jiān)局發(fā)布《關(guān)于開展2020年藥品制劑生產(chǎn)企業(yè)不良反應報告和監(jiān)測檢查工作的通知》。
通知要求,各藥品制劑生產(chǎn)企業(yè)嚴格按照公告及《總局關(guān)于印發(fā)藥品不良反應報告和監(jiān)測檢查指南(試行)的通知》(食藥監(jiān)藥化監(jiān)〔2015〕78號)等文件要求,于9月4日-9月16日認真開展自查工作。
建立健全藥品不良反應監(jiān)測體系,設(shè)立專門機構(gòu),配備專職人員,建立健全相關(guān)管理制度,直接報告藥品不良反應,開展藥品風險獲益評估,采取有效風險控制措施。整理相關(guān)資料,形成自查報告,于10月15日前將自查報告電子版報省藥品不良反應監(jiān)測中心。
根據(jù)通知要求,江西省藥監(jiān)局將組織檢查人員對以下名單內(nèi)企業(yè)開展不良反應報告和監(jiān)測現(xiàn)場專項檢查,一共33家藥企,檢查時間為9月下旬。


藥企必須重視這項工作
藥品不良反應報告和監(jiān)測,是指藥品不良反應的發(fā)現(xiàn)、報告、評價和控制的過程。藥品不良反應報告數(shù)量越多,并不說明藥品安全水平下降,而是意味著監(jiān)管部門掌握的信息越來越全面,對藥品的風險更了解,風險更可控。
幾乎所有的藥物都可引起不良反應,只是反應的程度和發(fā)生率不同。由于藥品的特殊性,上市前研究非常局限,需要通過廣泛的臨床應用方能發(fā)現(xiàn)其固有的風險。因此,通過加強藥品不良反應報告和監(jiān)測工作,及時發(fā)現(xiàn)藥品潛在固有風險,評價其風險效益比,不斷完善藥品的安全性信息,保護公眾的用藥安全。
國家藥監(jiān)局藥品不良反應監(jiān)測中心在4月10日發(fā)布《國家藥品不良反應監(jiān)測年度報告(2019年)》顯示,2019年全國藥品不良反應監(jiān)測網(wǎng)絡(luò)收到不良反應報告表151.4萬份,其中新的和嚴重藥品不良反應/事件報告47.7萬份,占同期報告總數(shù)的31.5%,較2018年下降1.6個百分點。
2019年藥品不良反應報告仍然以化學藥品為主,占比超八成,較2018年同期有所增長;中藥不良反應報告比例較2018年同期有所下降、生物制品略有上升。按照劑型統(tǒng)計,整體報告中注射劑占比超六成。
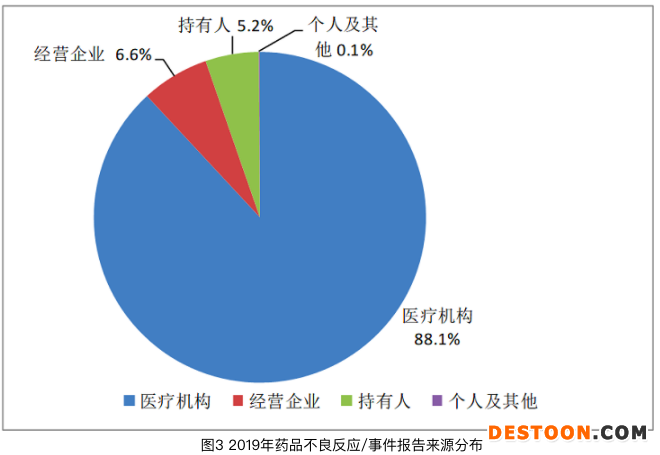
從《國家藥品不良反應監(jiān)測年度報告(2019年)》數(shù)據(jù)統(tǒng)計來看,2019年來自醫(yī)療機構(gòu)的報告占88.1%;來自經(jīng)營企業(yè)的報告占6.6%;來自持有人的報告占5.2%;來自個人及其他報告者的報告占0.1%。
據(jù)了解,美國90%的藥品不良反應來源于制藥企業(yè)。企業(yè)設(shè)有專門的機構(gòu)和人員收集不良反應病例,一旦發(fā)現(xiàn)藥品出現(xiàn)意外的有害反應時,即會采取有效措。
根據(jù)新修訂的《藥品管理法》第八十條規(guī)定,藥品上市許可持有人應當開展藥品上市后不良反應監(jiān)測,主動收集、跟蹤分析疑似藥品不良反應信息,對已識別風險的藥品及時采取風險控制措施。
此外,《藥品管理法》明確規(guī)定,對于持有人應報告而沒有報告不良反應的,未制定藥品上市后風險管理計劃的,責令限期改正,給予警告;逾期不改正的,處以罰款。
也就是說,作為藥品上市許可持有人的藥企必須要承擔藥品不良反應監(jiān)測的主體責任。
隨著新修訂《藥品管理法》的實施,我國藥企對于藥品不良反應監(jiān)測務必要越來越重視。有專家告訴賽柏藍,國內(nèi)藥企若能做好藥品不良反應監(jiān)測工作,國外監(jiān)管部門、公眾會認為這家藥企對藥品的質(zhì)量、安全性非常重視,這也將更有利于國內(nèi)藥企的藥品打入歐美市場及其他發(fā)達國家市場,更好的走向國際。
可以說,藥品不良反應報告和監(jiān)測,無論對企業(yè)自身還是醫(yī)藥行業(yè)的發(fā)展,都有很大的促進作用。這項工作走在前頭的藥企,也將會迎來更多的市場機會。




 110102000668(1)號
110102000668(1)號