石藥集團(tuán)日前發(fā)布公告,公司全資附屬公司上海津曼特生物科技有限公司與康諾亞生物醫(yī)藥科技(成都)有限公司(簡(jiǎn)稱(chēng)“康諾亞生物”)訂立協(xié)議,內(nèi)容是關(guān)于產(chǎn)品CM310在中重度哮喘和慢性阻塞性肺病(COPD)等呼吸系統(tǒng)疾病的獨(dú)家授權(quán)開(kāi)發(fā)及商業(yè)化。

CM310是康諾亞生物研發(fā)的具有自主知識(shí)產(chǎn)權(quán)的靶向人白細(xì)胞介素4受體α亞基(IL-4Rα)的重組人源化單克隆抗體注射液。具體到這一靶點(diǎn)領(lǐng)域,直接對(duì)標(biāo)的藥物正是賽諾菲的超級(jí)重磅品種Dupixent(Dupilumab,中文商品名:達(dá)必妥)。

今年2月初,賽諾菲公布2020年業(yè)績(jī)報(bào)告,凈收入360.41億歐元,同比下滑0.2%,Dupixent無(wú)疑是賽諾菲當(dāng)前最為倚重的產(chǎn)品。在中國(guó)市場(chǎng),去年6月,Dupixent獲國(guó)家藥品監(jiān)督管理局(NMPA)批準(zhǔn),并在新一輪醫(yī)保價(jià)格談判中迅速降價(jià)進(jìn)入醫(yī)保,市場(chǎng)推廣處在快速擴(kuò)張關(guān)鍵階段。
然而,與PD-1/L1領(lǐng)域市場(chǎng)局面相似,IL-4R也是眾多本土企業(yè)密集布局的重點(diǎn)領(lǐng)域。審評(píng)審批改革、醫(yī)保支付改革“雙輪驅(qū)動(dòng)”,本土創(chuàng)新藥物的可及性和可支付性正在得到改善,Dupixent所處的IL-4R賽道,是否也會(huì)在未來(lái)幾年遭遇如今PD-1/L1領(lǐng)域相同的競(jìng)爭(zhēng)場(chǎng)景?
進(jìn)口替代壓力陡增
Dupixent是賽諾菲/再生元合作開(kāi)發(fā)的一款靶向IL-4R的單克隆抗體藥物,自2017年3月首次獲得美國(guó)FDA批準(zhǔn)后,Dupixent就顯示出了驚人的市場(chǎng)爆發(fā)力。在此前賽諾菲的戰(zhàn)略規(guī)劃中,Dupixent與疫苗、研發(fā)管線(xiàn)、中國(guó)市場(chǎng)被共同視作驅(qū)動(dòng)其未來(lái)業(yè)績(jī)?cè)鲩L(zhǎng)的4大戰(zhàn)略方向,賽諾菲更是將Dupixent的銷(xiāo)售峰值目標(biāo)設(shè)定在“100億歐元”。
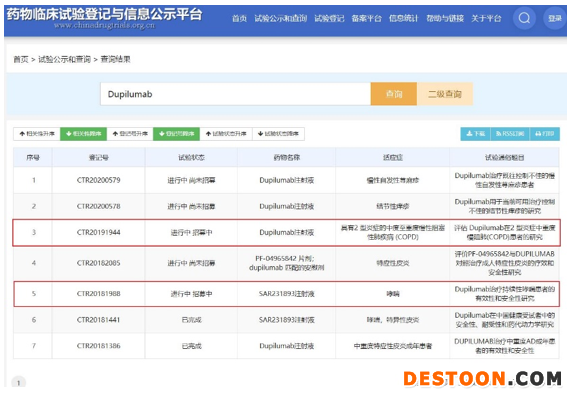
除了成人和兒童的特應(yīng)性皮炎,Dupixent在2018年10月已經(jīng)獲得美國(guó)FDA批準(zhǔn)成人中重度哮喘適應(yīng)癥。此外,慢性阻塞性肺?。–OPD)等呼吸系統(tǒng)疾病,同樣存在巨大的患者人群和未被滿(mǎn)足需求。目前,圍繞Dupixent的哮喘和COPD等呼吸疾病適應(yīng)癥,中國(guó)臨床試驗(yàn)也在推進(jìn)中。

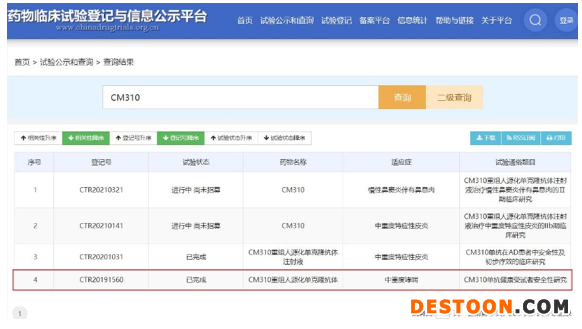
在石藥集團(tuán)此次的公告中,CM310呼吸系統(tǒng)疾病的開(kāi)發(fā)及商業(yè)化獨(dú)家權(quán)益,正是重要的交易籌碼。根據(jù)雙方協(xié)議,津曼特生物將獲得康諾亞生物授出該產(chǎn)品獨(dú)家權(quán)利,以于中華人民共和國(guó)(不包括香港特別行政區(qū)、澳門(mén)特別行政區(qū)及臺(tái)灣地區(qū))進(jìn)行該產(chǎn)品在該等適應(yīng)癥上的開(kāi)發(fā)與商業(yè)化,并成為上市許可持有人(MAH)。
截至目前,作為對(duì)標(biāo)Dupixent的創(chuàng)新產(chǎn)品,CM310在中國(guó)的中重度哮喘適應(yīng)癥于2019年7月獲臨床試驗(yàn)?zāi)驹S可,并且已經(jīng)開(kāi)展Ⅱ期臨床試驗(yàn)研究工作,未來(lái)按治療用生物制品1類(lèi)新藥申報(bào)。

市場(chǎng)分析認(rèn)為,考慮到Dupixent的特應(yīng)性皮炎適應(yīng)癥已經(jīng)上市,并在產(chǎn)品獲批半年之后快速進(jìn)入醫(yī)保,未來(lái)一段時(shí)間賽諾菲都將圍繞該產(chǎn)品的進(jìn)院和推廣投入巨大資源,力求在細(xì)分領(lǐng)域“高舉高打”構(gòu)筑先發(fā)優(yōu)勢(shì)。不過(guò),本土企業(yè)研發(fā)投入越來(lái)越多,F(xiàn)ast-follow研發(fā)策略跟進(jìn)越來(lái)越迅速,無(wú)論是特應(yīng)性皮炎還是呼吸疾病領(lǐng)域,本土me-too創(chuàng)新藥物對(duì)進(jìn)口創(chuàng)新產(chǎn)品的沖擊將越來(lái)越大。
做出這一判斷不無(wú)依據(jù)。2018年Opdivo和Keytruda獲批之后,隨著多款本土企業(yè)創(chuàng)新產(chǎn)品陸續(xù)上市,以恒瑞醫(yī)藥、百濟(jì)神州、君實(shí)生物、信達(dá)生物等企業(yè)為代表,國(guó)產(chǎn)PD-1相繼獲批,短短幾年就讓PD-1/L1市場(chǎng)掀起激烈競(jìng)爭(zhēng),而在國(guó)產(chǎn)PD-1進(jìn)入醫(yī)保后,默沙東和BMS不得不大幅調(diào)整贈(zèng)藥方案,以變相降價(jià)應(yīng)戰(zhàn)國(guó)產(chǎn)同類(lèi)產(chǎn)品進(jìn)入醫(yī)保后的市場(chǎng)局面。
如今,跨國(guó)企業(yè)正在全面加速全球創(chuàng)新產(chǎn)品進(jìn)入中國(guó)市場(chǎng)進(jìn)程,然而國(guó)家醫(yī)保局“錢(qián)袋子”也無(wú)法長(zhǎng)期為高昂的進(jìn)口藥物買(mǎi)單。不難預(yù)見(jiàn),在中國(guó)醫(yī)藥產(chǎn)業(yè)轉(zhuǎn)型升級(jí)大背景下,中國(guó)本土醫(yī)藥企業(yè)的產(chǎn)業(yè)創(chuàng)新不斷積蓄力量,進(jìn)口創(chuàng)新藥的本土替代壓力或?qū)⒊掷m(xù)增大,跨國(guó)企業(yè)必須更加主動(dòng)地適應(yīng)中國(guó)市場(chǎng)游戲規(guī)則。
本土創(chuàng)新質(zhì)量升級(jí)
藥品監(jiān)管制度改革持續(xù)深入,審評(píng)審批新藥數(shù)量逐年增加,創(chuàng)新藥市場(chǎng)競(jìng)爭(zhēng)形勢(shì)愈發(fā)復(fù)雜。特殊時(shí)間窗口涌現(xiàn)出的市場(chǎng)機(jī)會(huì)在得到眾多企業(yè)密集關(guān)注的同時(shí),新藥研發(fā)的臨床價(jià)值門(mén)檻也在逐步提升。
基于Th2通路在自身免疫疾病領(lǐng)域重大的臨床價(jià)值,多款I(lǐng)L-4 、IL-5、IL-13抗體新藥陸續(xù)獲批,全球范圍內(nèi)已經(jīng)有包括Dupilumab(IL-4R)、Mepolizumab(IL-5)、Benralizumab(IL-5R)、Reslizumab(IL-5)等在內(nèi)的多款產(chǎn)品。
具體到IL-4R領(lǐng)域,除了此次備受關(guān)注的康諾亞生物,在國(guó)內(nèi)還有包括康乃德(CBP-201)、康方生物(AK120)、恒瑞醫(yī)藥(SHR1819)、荃信生物(QX005N)、三生國(guó)?。?61)、麥濟(jì)生物(MG010)等企業(yè)布局。
顯然,與“千軍萬(wàn)馬”爭(zhēng)奪PD-1市場(chǎng)相似,未來(lái)IL-4R市場(chǎng)的競(jìng)爭(zhēng)戰(zhàn)火也將會(huì)異常激烈。同時(shí),每一次細(xì)分領(lǐng)域的局部市場(chǎng)洗牌,也考驗(yàn)著本土醫(yī)藥企業(yè)在技術(shù)、團(tuán)隊(duì)、執(zhí)行力、創(chuàng)新力等方面的綜合實(shí)力,從而讓一批極具潛力的創(chuàng)新公司實(shí)現(xiàn)跨越式發(fā)展,最終脫穎而出。
醫(yī)藥創(chuàng)新與風(fēng)險(xiǎn)如影隨形,正如百奧泰在短短一個(gè)月內(nèi)連續(xù)公告終止包括PD-1、Trop-2、HER2三個(gè)領(lǐng)域的項(xiàng)目,未來(lái)本土創(chuàng)新企業(yè)在IL-4R領(lǐng)域最終將誰(shuí)主沉浮依然值得期待。
行業(yè)人士認(rèn)為,跟隨的研發(fā)策略都是產(chǎn)業(yè)和企業(yè)發(fā)展的一個(gè)階段,無(wú)論是仿制藥還是me-too創(chuàng)新藥,對(duì)于豐富臨床用藥選擇、提高藥物可及性等方面,在一定程度上實(shí)現(xiàn)了進(jìn)口替代,為公眾健康提供了重要的保障,但更高價(jià)值的醫(yī)藥創(chuàng)新,核心追求還是聚焦未被滿(mǎn)足的臨床需求。
更值得關(guān)注的是,本土大型制藥公司已經(jīng)開(kāi)始看到中國(guó)醫(yī)藥產(chǎn)業(yè)的創(chuàng)新機(jī)會(huì),積極擁抱初創(chuàng)型生物醫(yī)藥創(chuàng)新公司進(jìn)行資源整合和產(chǎn)業(yè)鏈合作。除了石藥集團(tuán),此前一段時(shí)間,恒瑞醫(yī)藥投資瓔黎藥業(yè)、綠葉制藥收購(gòu)博安生物、華東醫(yī)藥入股荃信生物,圍繞本土醫(yī)藥創(chuàng)新的產(chǎn)業(yè)整合正在加速。



