3月30日訊 大批新藥即將上市
10款新藥上市有進展!基石、武田、諾華……
3月13日-3月26日期間,10個新藥(15個受理號)的上市申請有審評審批狀態(tài)更新。其中,基石藥業(yè)的普拉替尼膠囊附條件批準上市,協(xié)和發(fā)酵麒麟的布羅索尤單抗注射液、Celgene的來那度胺膠囊獲批新增適應癥。此外,再鼎醫(yī)藥的Ripretinib片、武田的醋酸艾替班特注射液、基石藥業(yè)的阿泊替尼片、諾華的二甲雙胍維格列汀片Ⅱ/Ⅲ……注冊辦理狀態(tài)變更為“在審批”。
(3.13-3.26)新藥上市申請審評審批狀態(tài)更新
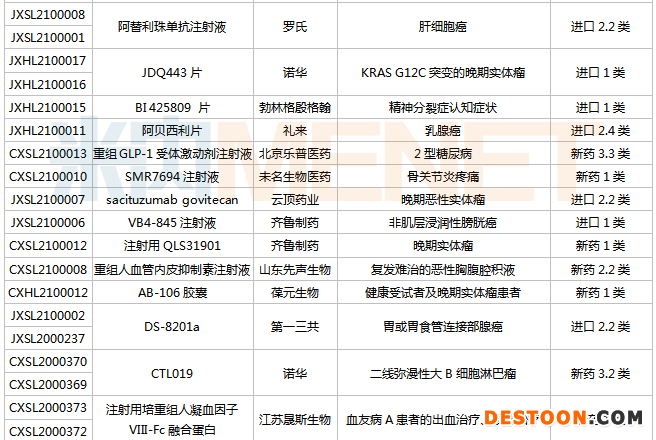
協(xié)和發(fā)酵麒麟的布羅索尤單抗是第一款靶向成纖維細胞生長因子23(FGF23)的重組全人單克隆IgG1抗體。布羅索尤單抗此前被納入第二批臨床急需境外新藥名單。2021年1月,國家藥監(jiān)局附條件批準布羅索尤單抗注射液上市,用于成人和1歲兒童患者X連鎖低磷血癥(XLH),此次獲批上市的適應癥為腫瘤相關骨軟化癥。
艾替班特是武田的一款罕見病用藥,屬于強力的選擇性的緩激肽B2受體拮抗劑,主要用于治療遺傳性血管水腫(HAE)急性發(fā)作。該產(chǎn)品于2008年7月在歐盟獲批上市,2011年8月在美國獲批上市,是FDA批準的第3個治療HAE發(fā)作的藥物,2019年全球銷售額為327億日元。
Ripretinib片是再鼎醫(yī)藥于2019年從Deciphera引進的一款酪氨酸激酶開關調控抑制劑,用于治療由KIT/PDGFRα驅動的胃腸道間質瘤(GIST)和其他實體腫瘤。
基石藥業(yè)附條件批準上市的普拉替尼膠囊是一款口服、強效、高選擇性的RET抑制劑,對攜帶RET融合陽性NSCLC患者具有廣泛和持久的抗腫瘤作用。普拉替尼是中國首個獲批上市的選擇性RET抑制劑,同時也是基石藥業(yè)首個商業(yè)化上市的產(chǎn)品。基石藥業(yè)是一家生物制藥公司,成立于2015年底,專注于開發(fā)及商業(yè)化創(chuàng)新腫瘤免疫治療及精準治療藥物。
值得一提的是,基石藥業(yè)另一款新藥阿泊替尼片注冊辦理狀態(tài)已變更為“在審批”,有望迎來獲批上市的喜訊。阿泊替尼片是一款口服、強效、高選擇性的KIT/PDGFRA突變激酶抑制劑,是針對這類突變的最新精準靶向治療手段。
目前國內(nèi)以替尼類為代表的抗腫瘤藥研發(fā)扎堆,呈現(xiàn)“大爆炸”態(tài)勢。短短不到3個月,國內(nèi)已有3款替尼類藥物獲批上市,包括索凡替尼、伏美替尼及普拉替尼。替尼即酪氨酸激酶抑制劑,是一種小分子蛋白激酶抑制劑,具有阻斷一種或多種蛋白激酶的作用。替尼類藥物市場潛力巨大,米內(nèi)網(wǎng)數(shù)據(jù)顯示,2019年中國公立醫(yī)療機構終端蛋白激酶抑制劑銷售額超過200億元,同比增長59.53%。
4款新藥申請上市!恒瑞PD-1再報新適應癥
3月13日-3月26日期間,4個新藥(6個受理號)上市申請獲得CDE承辦。進口新藥方面,云頂新耀的依拉環(huán)素和泊諾創(chuàng)新的匹美西林提交上市申請。國產(chǎn)新藥方面,恒瑞醫(yī)藥的卡瑞利珠(PD-1)申報新適應癥,此前獲批的四個適應癥均已進入國家醫(yī)保目錄。
(3.13-3.26)獲承辦的國產(chǎn)/進口新藥上市申請
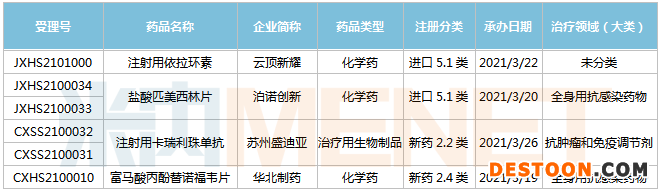
華北制藥提交富馬酸丙酚替諾福韋片的新適應癥上市申請。丙酚替諾福韋是治療成人和青少年慢性乙型肝炎的抗病毒強效藥,是全球乙肝治療一線用藥。丙酚替諾福韋由吉利德開發(fā),商品名為Vemlidy(韋立得),有著“史上最強乙肝藥物”之稱。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2020年Vemlidy全球銷售額為6.57億美元,同比增長35%。
XeravaTM(依拉環(huán)素,Eravacycline)是一種注射用新型全合成的廣譜四環(huán)素類非腸道抗生素,對多重耐藥性革蘭氏陰性菌等中國常見的耐藥菌具有廣泛的體外抗菌活性。云頂新耀從Tetraphse制藥公司獲得XeravaTM的商業(yè)許可,擁有該藥在大中華區(qū)、韓國和部分東南亞主要市場研發(fā)、商業(yè)化的獨家權益。
依拉環(huán)素目前已在美國和歐洲獲批用于治療復雜性腹腔內(nèi)感染(cIAI),且于2020年4月在新加坡獲批。依拉環(huán)素國內(nèi)已上市同類藥品有替加環(huán)素等,近幾年替加環(huán)素國內(nèi)市場規(guī)模持續(xù)攀升,米內(nèi)網(wǎng)數(shù)據(jù)顯示,2019年中國公立醫(yī)療機構終端替加環(huán)素銷售額超過26億元,同比增長25.35%。
奧賽康、齊魯、東陽光藥……43個新藥獲批臨床
3月13日-3月26日期間,43個新藥(涉及59個受理號)獲得臨床試驗默示許可。其中,31個品種(41個受理號)為國產(chǎn)新藥,12個品種(18個受理號)為進口新藥。從藥品類型看,中成藥有5個、化學藥有17個、治療用生物制品有21個。
(3.13-3.26)獲批臨床的國產(chǎn)/進口新藥


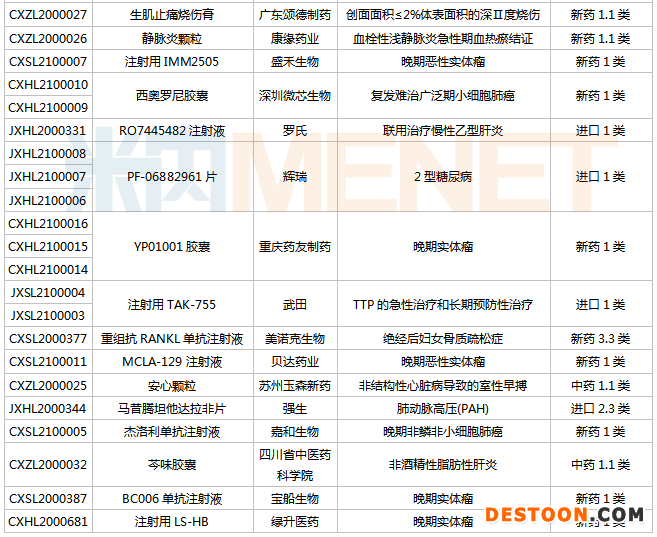
麥芽酚鐵膠囊由奧賽康從英國Shield TX公司引進,已在歐盟和美國獲批用于治療成人鐵缺乏癥。該藥活性成分麥芽酚鐵是一種鐵與麥芽酚形成的化學性質穩(wěn)定的新型非鹽復合物,具有獨特的吸收機制。系列臨床試驗證實,麥芽酚鐵膠囊是一種不良反應發(fā)生率低,生物利用度高且不易發(fā)生鐵過載、耐受性良好的治療成人鐵缺乏癥的口服藥物。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2019年中國公立醫(yī)療機構及中國城市實體藥店終端鐵制劑市場規(guī)模超過40億元,同比增長約12%,潛在患者群及市場規(guī)模較大。
東陽光藥的3.3類生物藥德谷胰島素注射液是一種長效胰島素,用于需要胰島素治療的糖尿病患者。目前國內(nèi)市場僅有諾和諾德的德谷胰島素注射液獲批進口。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2020年諾和諾德的德谷胰島素全球銷售額為89.68億丹麥克朗,其中中國市場銷售額為4.18億丹麥克朗。
寶船生物的BC006單抗注射液是抗巨噬細胞集落刺激因子1受體(CSF-1R)的人源化IgG1單克隆抗體,特異性靶向作用于單核-巨噬細胞系膜表面的CSF-1R,擬用于治療晚期惡性腫瘤。BC006單抗注射液獲批臨床,標志著我國第一個CSF-1R抗體藥物成功進入臨床開發(fā)階段,填補了國內(nèi)該靶點研發(fā)的空白,在國外針對該靶點的臨床研究也在早期階段。
復星醫(yī)藥控股子公司重慶藥友制藥的YP01001膠囊為創(chuàng)新型小分子化學藥物,擬用于治療晚期實體瘤。YP01001膠囊的國內(nèi)已上市同類藥品有甲磺酸侖伐替尼膠囊等。米內(nèi)網(wǎng)數(shù)據(jù)顯示,侖伐替尼上市后銷售額一路飛漲,2019年衛(wèi)材的侖伐替尼全球銷售額達1119億日元。
齊魯制藥有2款1類新藥獲批臨床,分別為VB4-845注射液和注射用QLS31901。注射用QLS31901擬用于治療晚期實體瘤,VB4-845注射液用于治療非肌層浸潤性膀胱癌。VB4-845(Vicineum)是齊魯制藥以3500萬美元從Sesen Bio引進的一款抗體藥物偶聯(lián)物(ADC),是以腫瘤細胞表面的上皮細胞粘附分子(EpCAM)抗原為靶點的人源化scFv免疫毒素。VB4-845已獲美國FDA和歐盟EMA授予孤兒藥資格,2020年12月Sesen Bio向美國FDA提交該藥的完整生物制品許可申請(BLA),預計在2021年年中獲得批準。
樂普醫(yī)藥的3.3類生物藥重組GLP-1受體激動劑注射液是度拉糖肽注射液的生物類似藥。度拉糖肽注射液由禮來研發(fā),已獲批用于治療成人2型糖尿病和預防2型糖尿?。═2DM)患者心血管事件風險。米內(nèi)網(wǎng)數(shù)據(jù)顯示,禮來的度拉糖肽2020年全球銷售額為50.68億美元,同比增長23%。
1類創(chuàng)新藥PF-06882961片是輝瑞開發(fā)的一款口服小分子GLP-1受體激動劑。該款小分子藥物有別于注射用和口服用肽類GLP-1RA,能夠為糖尿病和肥胖癥患者提供一款差異化的創(chuàng)新療法。
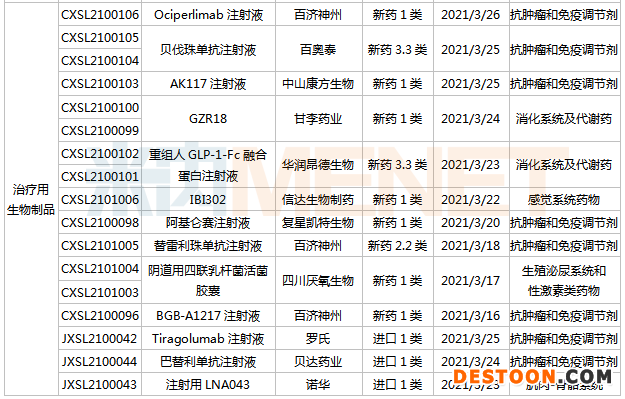
信達、科倫、衛(wèi)材……40個新藥臨床申請獲承辦
3月13日-3月26日期間,40個新藥(涉及73個受理號)的臨床申請獲CDE承辦受理。其中,29個品種(49個受理號)為國產(chǎn)新藥,11個品種(24個受理號)為進口新藥。從藥物類型看,中成藥有1個、化學藥有26個、治療用生物制品有13個。
(3.13-3.26)獲承辦的國產(chǎn)/進口新藥臨床申請
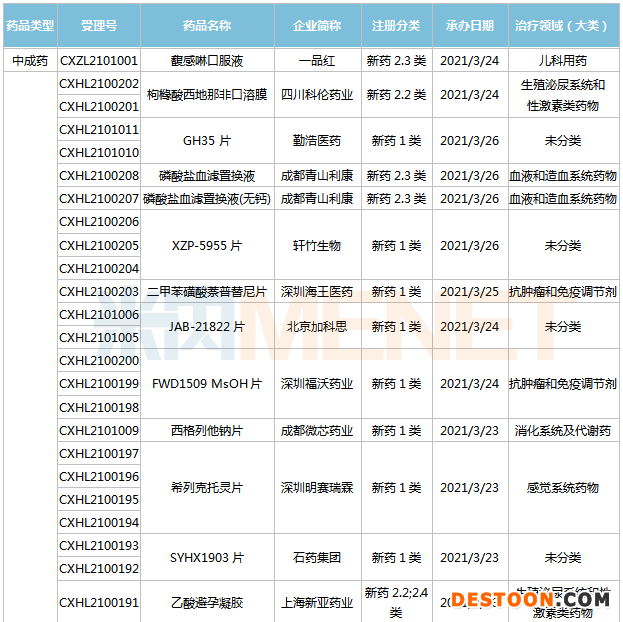
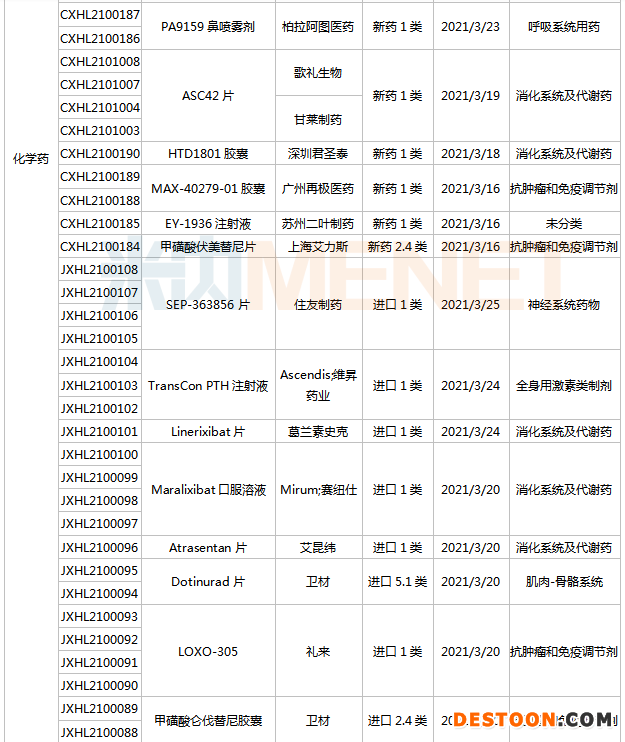
1類生物藥IBI302是信達生物自主研發(fā)的用于治療眼底病的創(chuàng)新藥物,屬國際首創(chuàng)抗VEGF-抗補體雙靶點分子。IBI302擬用于治療新生血管性年齡相關性黃斑變性(nAMD),其雙靶點設計有望實現(xiàn)對AMD的病因進行更加針對性的治療和干預,并帶來相對于VEGF單靶藥物更多的臨床獲益。
GZR18是甘李藥業(yè)自主研發(fā)的每周注射一次的胰高血糖素樣肽1(GLP-1)受體激動劑類藥物,適應癥包括II型糖尿病、肥胖及超重。全球范圍內(nèi),目前尚無一周注射一次的GLP-1受體激動劑類藥物被批準用于肥胖及超重治療。
歌禮制藥的ASC42片是一款best-in-class的法尼醇X受體(FXR)激動劑。在兩個NASH動物模型中,ASC42表現(xiàn)出對肝脂肪變性、炎癥和纖維化的顯著改善。2020年10月,ASC42片獲美國FDA批準開展非酒精性脂肪性肝炎(NASH)適應癥的臨床試驗。值得一提的是,歌禮制藥的NASH管線中還有兩款在研藥物,包括處于I期臨床試驗的ASC41和已申報IND的ASC40片。
科倫藥業(yè)的枸櫞酸西地那非口溶膜為國內(nèi)首家提交臨床申請,也是公司首個亮相的口溶膜劑。西地那非是一種5型磷酸二酯酶(PDE-5)選擇性抑制劑,用于治療勃起功能障礙(ED)。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2019年中國城市實體藥店終端西地那非銷售額超過23億元。值得一提的是,科倫藥業(yè)的枸櫞酸西地那非口崩片已首家提交上市申請,可見公司對男科用藥市場的重視。
Dotinurad片是一種尿酸鹽重吸收抑制劑,可以靶向抑制尿酸鹽重吸收轉運子(URAT1)活性。2020年1月23日,Dotinurad片獲日本PMDA批準用于治療高尿酸血癥引起的痛風。2020年2月25日,衛(wèi)材株式會社和富士藥品株式會社宣布,已就Dotinurad達成許可協(xié)議,衛(wèi)材將負責其產(chǎn)品在中國市場的獨家開發(fā)和銷售。
目前,國內(nèi)抗痛風藥市場領軍品種為非布司他,已納入第三批集采。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2019年中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)及中國城市實體藥店終端非布司他銷售額接近20億元。
數(shù)據(jù)來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、CDE、公司公告。數(shù)據(jù)統(tǒng)計時間段為3月13日-3月26日,按藥品名稱統(tǒng)計(不含預防用生物制品、體外診斷試劑等,不含補充申請),如有疏漏,歡迎指正!
注:米內(nèi)網(wǎng)中國城市實體藥店終端競爭格局數(shù)據(jù)庫是覆蓋全國293個地市及以上城市實體藥店(不含縣鄉(xiāng)村實體藥店),對全品類進行連續(xù)監(jiān)測的放大版城市實體藥店數(shù)據(jù)庫。上述銷售額以產(chǎn)品在終端的平均零售價計算。



