近日,生物類似藥領域暗流涌動。往遠處看,韓國藥企Celltrion宣布,其利妥昔單抗生物類似藥Truxima至今年第二季度,在英國、法國、意大利、德國和西班牙的市場份額合計已達46%,這5國約占歐洲利妥昔單抗市場的70%。從整個歐洲市場來看,該藥的份額也超過了40%,歐洲市場又一原研藥被類似藥趕超。
近看國內市場,競爭形勢更為激烈。以貝伐珠單抗為例,生物類似藥全面開花,并已形成“1+6”格局:貝達的貝伐珠單抗生物類似藥剛剛獲批。稍早前,羅氏的貝伐珠單抗獲批兩項婦科腫瘤新適應證,而百奧泰的貝伐珠單抗生物類似藥獲批非小細胞肺癌和結直腸癌兩種適應證。國內還有齊魯、信達、綠葉和恒瑞等實力選手,今年上半年,在重點省市公立醫(yī)院西藥銷量前10的藥品中,齊魯的貝伐珠單抗增速最快,市場份額趕超原研藥,加之復宏漢霖、康寧杰瑞等20余家企業(yè)仍在該領域競跑,競爭態(tài)勢異常激烈。
足見,生物類似藥在全球范圍內強勢崛起,尤其在中國更是勢如破竹。
卡位戰(zhàn)賽況焦灼
當前,臨床上熱銷的重磅生物藥均面臨著其類似藥的全面沖擊。
利妥昔單抗生物類似藥在歐洲趕超原研藥。而在中國,2019年復宏漢霖的利妥昔單抗生物類似藥在國內獲批上市后,首個國產生物類似藥打破原研藥十數年的市場獨占。信達隨后跟進,相關臨床試驗還有10多項,處于臨床Ⅲ期以上的就有7家。
由此帶來的局面是,截至今年上半年,首款利妥昔單抗生物類似藥已完成國內30個省市的醫(yī)保開通,七成以上核心醫(yī)院實現進藥,2020年在國內銷售額快速增長,而原研藥Rituxan在中國區(qū)的銷售額則下降23%。
不僅如此,利妥昔單抗的全球競爭更加白熱化。在生物類似藥最成熟的歐洲市場,首個獲批的利妥昔單抗生物類似藥已反超原研藥。分析歐洲替代曲線可以看到:首個生物類似藥上市后平均5年占市場份額(含原研藥和生物類似藥)超過40%。平均而言,在歐洲生物藥市場,首個上市生物類似藥具有先發(fā)優(yōu)勢,Truxima用最新數據豐富了這一曲線。國內首款利妥昔單抗生物類似藥也在哥倫比亞、秘魯、厄瓜多爾及委內瑞拉等拉美國家布局,生物藥的全球競爭更加充分。
處于同樣局面的生物藥還有貝伐珠單抗。截至今年11月,FDA批準的31個生物類似藥中,貝伐珠單抗類似藥尤為搶眼,新獲批的Mvasi和Zirabev:前者2019年在Avastin專利到期后正式在美銷售,上市第2年就取得7.98億美元的收入;后者2020年首年銷售額達1.43億美元,這些類似藥給原研藥帶來巨大競爭壓力。
表1 上半年重點省市公立醫(yī)院西藥銷量前10藥品
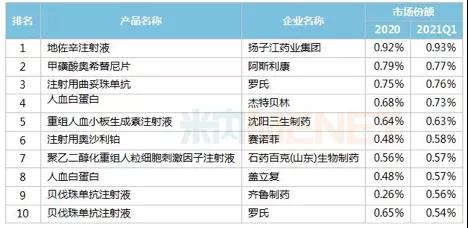
數據來自:米內網數據庫
在國內,已上市銷售的貝伐珠單抗中,原研藥與齊魯的生物類似藥各有千秋,其他產品因商業(yè)布局尚在起步階段,市占率較低。從趨勢看,后來者或通過適應癥差異化策略突圍,如貝達與復宏漢霖選擇了轉移性結直腸癌適應癥,區(qū)別于目前國內已上市的貝伐珠單抗生物類似藥;或是向海外延伸,如信達積極布局了美國和加拿大及印度尼西亞的海外權益。百奧泰與諾華子公司Sandoz合作將貝伐珠單抗類似藥有條件在歐美及加拿大等國際市場擴展,全面多維競爭格局一觸即發(fā)。
就阿達木單抗而言,近年艾伯維的Humira全球銷售額在增長,但在國內銷售額卻逐步下滑,且銷售規(guī)模遠低于歐美市場,替代潛力也很大。百奧泰、海正等企業(yè)已上位,外加46個臨床試驗仍在進行。包含阿達木單抗在內的重磅生物藥加速分化,在價格逐漸縮小差距的情況下,適應癥成為決勝的關鍵,阿達木單抗目前國內適應癥偏少,因而生物類似藥在這場“叢林法則”的較量中表現突出。
同質化加劇,市場代替拼速度
盡管生物類似藥惹人關注,但這也并非機會均等的盛宴。如果把這種競爭格局聚焦到中國市場來觀察,爭一保二遠觀三四將是未來的競爭要塞。
首先,生物類似藥在臨床上的應用逐漸得到認可。CDE發(fā)布的《生物類似藥相似性評價和適應癥外推技術指導原則》強調,通過擬外推適應癥相關研究數據和信息的科學論證,支持其用于參照藥中國獲批的其他未經直接研究的適應癥。
在此情況下,生物類似藥大展拳腳需差異化適應癥策略和研發(fā)速度的比較優(yōu)勢。類似藥在歐洲市場份額平均達到44.1%,后來者在搶占市場方面稍顯乏力。如被EMA批準上市的Remicade第二個生物類似藥Flixabi進入歐洲市場后,在與原研和首家生物類似藥的角逐下,第一年搶到0.7%的市場份額,第二年市場份額占比上升到3.4%,但不到原研藥上市第二年市場份額的1/3。若以此類推,國內生物藥市場也將面臨著同樣的考驗。
圖1 不同靶點的臨床試驗數量

數據來自:《中國新藥注冊臨床試驗現狀年度報告》
2020年國內藥物臨床試驗有2602項,較上年增長9.1%,國內申辦者占比超過70%,且前10位靶點中有9個靶點的藥物集中在同一適應癥上,其中7個靶點的藥物品種的適應癥超過90%的占比集中在抗腫瘤領域。這說明腫瘤藥創(chuàng)新繁榮的背后,誰能先人一步獲批上市關乎市場成敗。
而奮楫者先在現實中也遇到新挑戰(zhàn):受試者招募日漸成為影響臨床試驗速度的關鍵要素。目前PD-1、VEGFR等靶點的品種開展的臨床試驗均超過60項;另外,6個靶點的藥物臨床試驗中Ⅰ期的占比均超過40%,Ⅱ期臨床試驗在各靶點中的占比均不高,而PD-1、VEGFR等靶點的臨床試驗Ⅲ期均高達20項。
表2 臨床試驗目標入組人數分布
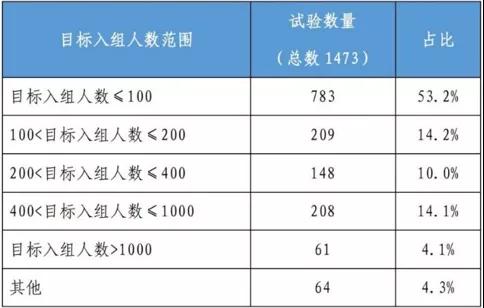
數據來自:《中國新藥注冊臨床試驗現狀年度報告》
官方披露,2020年登記的臨床試驗中,臨床試驗獲批后一年內啟動受試者招募的比例不足一半(45.4%);2020年完成的臨床試驗中仍以Ⅰ期臨床試驗為主,2020年的藥物臨床試驗仍以國內臨床試驗為主,占比達91.6%,國際多中心試驗僅占8.1%,包括生物類似藥在內的國內競爭會更激烈。目前,貝伐珠單抗、曲妥珠單抗等上述熱銷類似藥臨床研究都在延伸至海外。然而,對不在中國招募受試者或僅在國外開展的單中心臨床試驗,其占比僅為0.3%;國際多中心試驗占比相對較高,為14.1%。不少企業(yè)反饋,“臨床試驗的時間成本和機會成本在增加。”受試者資源緊張,必然影響項目的速度和占位。
成本優(yōu)勢取勝,實現覆蓋最大化
盡管生物類似藥臨床應用仍有不同觀點,且雖已證實生物類類藥與原研生物藥的安全性有效性無顯著性差別,但客觀來講,針對臨床用藥互換的研究總體上仍待加強。臨床證據有限也影響了臨床用藥的態(tài)度。有專家建議,政策上應多鼓勵企業(yè)報告上市后生物類似藥與原研生物藥在不同轉換場景中患者安全性和免疫原性等數據。
況且,胰島素完成帶量采購后,生物藥集采擴面肯定還會加碼。
因而,產品上市后,還得考驗成本優(yōu)勢及產品覆蓋能力。在保障高品質的同時拼成本優(yōu)勢將是大趨勢。最近,默克利用在抗體強化工藝、連續(xù)工藝過程設備、經濟適用型培養(yǎng)基開發(fā)等方面的優(yōu)勢,與博安生物的平臺技術及產業(yè)鏈合作,將進一步提升其生產效能,優(yōu)化生產成本,這種合作遠超單一產品的商業(yè)價值。
博安生物的貝伐珠單抗生物類似藥“前有猛虎,后有追兵”,其商業(yè)化打法就是除自建商業(yè)團隊外,選擇與阿斯利康合作,授權后者在中國21個省市區(qū)的縣域地區(qū)獨家推廣該藥品,通過資源協(xié)同實現產品覆蓋最大化,這在生物類似藥競爭策略中是很重要的一個切入點。
百奧泰也深諳此道。今年年初,忍痛連續(xù)砍掉2個ADC藥物研發(fā)項目,通過瘦身行動聚焦,其2021年中報顯示,在研13款藥物當中,貝伐珠單抗、托珠單抗、司庫奇尤單抗及戈利木單抗4款生物類似藥的累計研發(fā)投入達11.3億元,占到總研發(fā)費用的近75%,百奧泰希望在靶點成熟品種中做到同類最佳。去年8月,其將貝伐珠單抗在中國的商業(yè)化權益給了百濟神州以謀求更大的渠道覆蓋,能否沖出“叢林”有待市場檢驗。
隨著跨國企業(yè)在中國的可持續(xù)發(fā)展,逐漸以中國為中心加強本地化,而中國的創(chuàng)新企業(yè)要可持續(xù)發(fā)展,也在逐步國際化,生物藥之間的競爭也將更加錯綜復雜,有了產品還考驗企業(yè)的綜合實力。



