近日,榮昌生物發(fā)布招股書,2021年公司營收增速格外亮眼,同比增長高達(dá)468倍。目前榮昌生物已開發(fā)了20余款候選創(chuàng)新藥項(xiàng)目,其中泰它西普與維迪西妥單抗已獲批上市,并實(shí)現(xiàn)“當(dāng)年上市當(dāng)年入保”,此外有5款1類新藥已步入臨床試驗(yàn)階段,集中在ADC藥物領(lǐng)域。
營收增長468倍,5款1類新藥在路上
3月14日,榮昌生物披露科創(chuàng)板上市招股意向書,正式進(jìn)入發(fā)行階段,此次榮昌生物首次公開發(fā)行的股票數(shù)量約5442.63萬股,擬募集資金40億元,將用于生物新藥產(chǎn)業(yè)化項(xiàng)目、抗腫瘤抗體新藥研發(fā)項(xiàng)目、自身免疫及眼科疾病抗體新藥研發(fā)項(xiàng)目等。
2020年11月,榮昌生物在港交所掛牌上市,若此次科創(chuàng)板成功上市,公司將成為“H+A”醫(yī)藥股。此次A股上市,榮昌生物采用了科創(chuàng)板的第五套上市標(biāo)準(zhǔn),對此榮昌生物特別表示,如果公司無法保證未來幾年內(nèi)實(shí)現(xiàn)盈利(即經(jīng)審計(jì)扣除非經(jīng)常性損益前后的凈利潤(含被追溯重述)為負(fù)且營業(yè)收入(含被追溯重述)低于1億元,或經(jīng)審計(jì)的凈資產(chǎn)(含被追溯重述)為負(fù)),公司A股上市后可能面臨退市的風(fēng)險(xiǎn)。
2021年榮昌生物年度營收達(dá)14.3億元,同比增長46753.31%,凈利潤為2.8億元,同比增長139.59%,其中營收大幅度增長主要為企業(yè)產(chǎn)品上市首次實(shí)現(xiàn)盈利所致。從此次的營收狀況來看,榮昌生物未來有望穩(wěn)扎在科創(chuàng)板A股市場中。
據(jù)招股書顯示,2018-2020年榮昌生物研發(fā)費(fèi)用年復(fù)合增長率46.7%,合計(jì)研發(fā)費(fèi)用超過10億元。2021年公司研發(fā)費(fèi)用達(dá)7.1億元,同比增長52.63%。榮昌生物堅(jiān)持同類首創(chuàng)(first-in-class)與同類最佳(best-in-class)并重的發(fā)展模式,目前已開發(fā)了20余款候選生物制品創(chuàng)新藥,其中2款已獲批上市,5款產(chǎn)品已步入臨床試驗(yàn)階段(不含已上市新藥開拓新適應(yīng)癥)。在這7款藥品中,有6款為1類新藥。
榮昌生物上市藥物

來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)
1類新藥泰它西普(RC18)以及2.2類改良新藥維迪西妥單抗(RC48)均實(shí)現(xiàn)了“當(dāng)年上市當(dāng)年入保”,醫(yī)保支付標(biāo)準(zhǔn)分別為818.8元/支(規(guī)格80mg)、3800元/支(規(guī)格60mg)。泰它西普于2021年3月獲批用于治療系統(tǒng)性紅斑狼瘡,2021年上半年收入為2919.19萬元;維迪西妥單抗于2021年6月獲批,為國產(chǎn)首款上市的ADC藥物,目前該藥已有轉(zhuǎn)移性胃癌、尿路上皮癌兩種適應(yīng)癥獲批。截至2021年末,維迪西妥單抗銷售隊(duì)伍約180人,預(yù)計(jì)2022年銷售金額約為4億元。
從在研候選藥物來看,RC-28已步入臨床Ⅱ期階段,RC88、RC98、RC108以及RC118四款均處于臨床Ⅰ期階段。其中RC88、RC108、RC118三款均為ADC藥物,RC88(MSLN)以及RC118(CLDN18)兩款所對應(yīng)靶點(diǎn)在全球目前未有藥品上市。除此之外,榮昌生物還有10款候選藥尚處于IND準(zhǔn)備階段。
榮昌生物臨床階段在研藥物
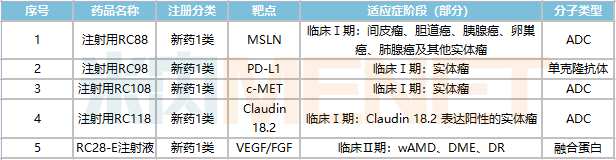
來源:米內(nèi)網(wǎng)中國藥品臨床試驗(yàn)公示庫
沖刺ADC與雙抗藥物領(lǐng)域,市場有望超400億美元
在工藝技術(shù)上,榮昌生物專注于抗體偶聯(lián)藥物(ADC)、抗體融合蛋白、單克隆抗體及雙特異性抗體等治療性抗體藥物的研發(fā)。其中,ADC藥物以及雙特異性抗體為企業(yè)目前重點(diǎn)布局的領(lǐng)域,其中ADC藥物共7款,雙特異性抗體藥物共5款。
近年來,ADC藥物以及雙特異性抗體均為新藥研發(fā)的熱點(diǎn)。業(yè)內(nèi)估計(jì),未來幾年兩個(gè)領(lǐng)域的全球藥物市場有望超過400億美元。
ADC藥物全球發(fā)展歷史已超過20年,目前已經(jīng)歷了四代發(fā)展。2000年,輝瑞的吉妥珠單抗獲批上市,成為全球首款獲批的ADC藥物。但當(dāng)時(shí)ADC藥物并未在全球醫(yī)藥界激起很大的浪花,并且當(dāng)時(shí)該款藥物脫靶毒性高,藥物效力低,因此在2010年黯然撤市,后又以更低的分級劑量于2017年重新上市。2018年,全球ADC藥物研發(fā)熱潮迸發(fā),與第一代的吉妥珠單抗相比,以戈沙妥組單抗為代表的最新一代ADC藥物實(shí)現(xiàn)了高DAR值、低毒性以及強(qiáng)穩(wěn)定等改良,其特點(diǎn)之一是啟用了喜樹堿類TOP1抑制劑作為低毒性的毒素。
據(jù)米內(nèi)網(wǎng)全球新藥研發(fā)數(shù)據(jù)顯示,目前全球在研ADC新藥項(xiàng)目超過600個(gè),不過多數(shù)處于藥物發(fā)現(xiàn)及臨床前階段,已獲批上市的ADC新藥共16款,包括恩美曲妥珠單抗、維博妥珠單抗、戈沙妥組單抗、替伊莫單抗、維布妥昔單抗等,其中羅氏的恩美曲妥珠單抗2021年全球銷售額達(dá)19.82億瑞士法郎。
全球已獲批上市的ADC藥物
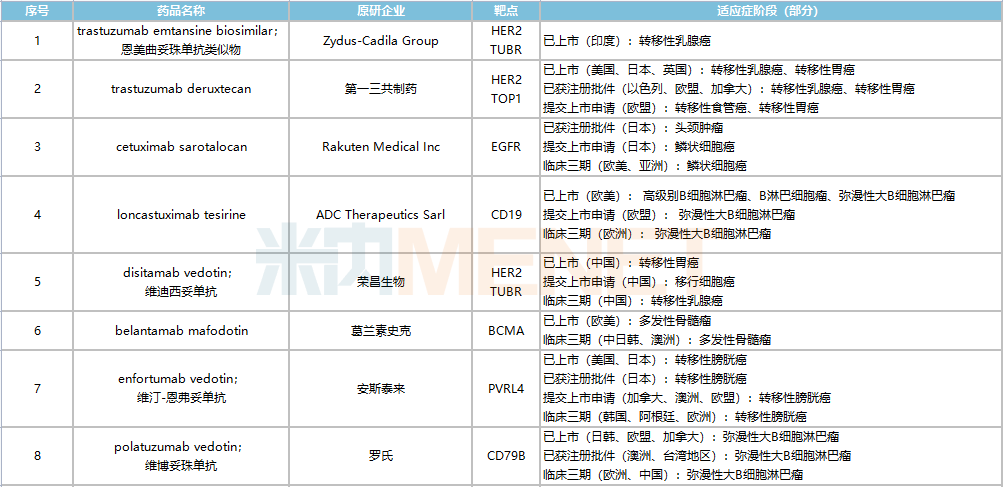
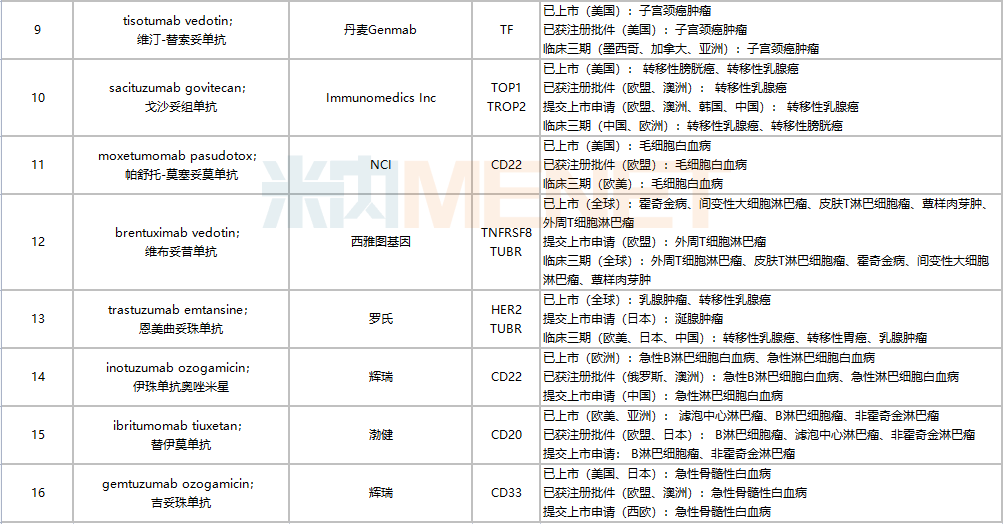
來源:米內(nèi)網(wǎng)全球新藥研發(fā)數(shù)據(jù)庫
在國內(nèi)ADC藥物的研發(fā)進(jìn)展上,百奧泰、東曜等企業(yè)相關(guān)藥物已步入臨床Ⅲ期階段,恒瑞、科倫、美雅珂等企業(yè)處于臨床Ⅱ期階段。
從雙特異性抗體藥物來看,由于研發(fā)技術(shù)難度的限制,目前全球已上市的雙特異性抗體藥物寥寥無幾。2009年,TRION的卡妥索單抗獲批上市,為全球首款雙特異性抗體藥物。不過,首款上市十多年來,全球新增上市的雙特異性抗體藥物僅有羅氏的艾美賽珠單抗、強(qiáng)生的埃萬妥單抗以及安進(jìn)的倍林妥莫雙抗3款。2020年,羅氏的艾美賽珠單抗全球銷售額達(dá)21.9億瑞士法郎,成為當(dāng)時(shí)首個(gè)銷售額進(jìn)入全球TOP100的雙特異性抗體藥物,2021年該款藥物銷售額已突破30億瑞士法郎。
全球已上市雙抗藥物

來源:米內(nèi)網(wǎng)全球新藥研發(fā)數(shù)據(jù)庫
據(jù)米內(nèi)網(wǎng)全球新藥研發(fā)數(shù)據(jù)顯示,全球雙特異性抗體藥物在研項(xiàng)目已超過1000個(gè),除了4個(gè)上市藥品外,還有3款已提交上市申請,包括康方生物的cadonilimab(NMPA)、羅氏的faricimab以及勃林格殷格翰的奧佐利珠單抗,此外康寧杰瑞、百利天、輝瑞、諾和諾德等企業(yè)的12款藥品已進(jìn)入臨床Ⅲ期階段。由此看來,未來康方生物的cadonilimab有望成為國產(chǎn)首款雙抗藥物。
來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、公司公告等



