20多年前,利妥昔單抗(Rituximab)是全球第一個(gè)上市的抗腫瘤單抗;20多年后,作為國(guó)內(nèi)首個(gè)納入集采的生物類似藥,利妥昔話題程度不減當(dāng)年。
01 源起:CD20靶點(diǎn)
利妥昔單抗是一種采用基因工程技術(shù)合成的人鼠嵌合單克隆抗體,由人源IgG1kappa恒定區(qū)和鼠源CD20抗體可變區(qū)組成。利妥昔單抗能特異性結(jié)合B細(xì)胞表面跨膜蛋白CD20,通過抗體依賴細(xì)胞介導(dǎo)的細(xì)胞毒作用(ADCC)和補(bǔ)體依賴的細(xì)胞毒作用(CDC)兩種途徑殺傷CD20陽性的B淋巴細(xì)胞。
CD20(Clusterof Differentiation20)是一種跨膜蛋白,位于B淋巴細(xì)胞表面。B淋巴細(xì)胞是由骨髓內(nèi)多能干細(xì)胞分化而成,其發(fā)育經(jīng)過祖B細(xì)胞(Pro-B),前B細(xì)胞(Pre-B),不成熟B細(xì)胞(ImmatureB)以及成熟B細(xì)胞(MatureB)幾個(gè)階段。成熟B細(xì)胞被釋放至淋巴組織,可繼續(xù)分化為漿細(xì)胞(PlasmaCell)。CD20作為B細(xì)胞的表面抗原,出現(xiàn)在前B細(xì)胞到成熟B細(xì)胞階段,但是CD20并不表達(dá)在造血干細(xì)胞,祖B細(xì)胞以及成熟的漿細(xì)胞上。
除在正常B細(xì)胞中表達(dá)外,CD20還在B細(xì)胞來源的淋巴瘤、白血病等的腫瘤細(xì)胞表達(dá),以及涉及免疫疾病和炎癥疾病的B細(xì)胞中表達(dá),所以CD20抗原成為淋巴癌、白血病和某些自體免疫等疾病治療的目標(biāo)靶點(diǎn)。雖然攻擊帶有CD20蛋白的腫瘤細(xì)胞的同時(shí),也會(huì)誤殺正常B細(xì)胞,但副作用相對(duì)可控。
02 適應(yīng)癥概覽
作為全球首個(gè)靶向CD20的單抗,截至目前利妥昔單抗已獲批15種適應(yīng)癥,其中7種適應(yīng)癥集中在淋巴瘤和淋巴細(xì)胞白血病領(lǐng)域,8種適應(yīng)癥和免疫疾病與炎癥疾病相關(guān),另外還有3種適應(yīng)癥處于臨床前和臨床研發(fā)階段。
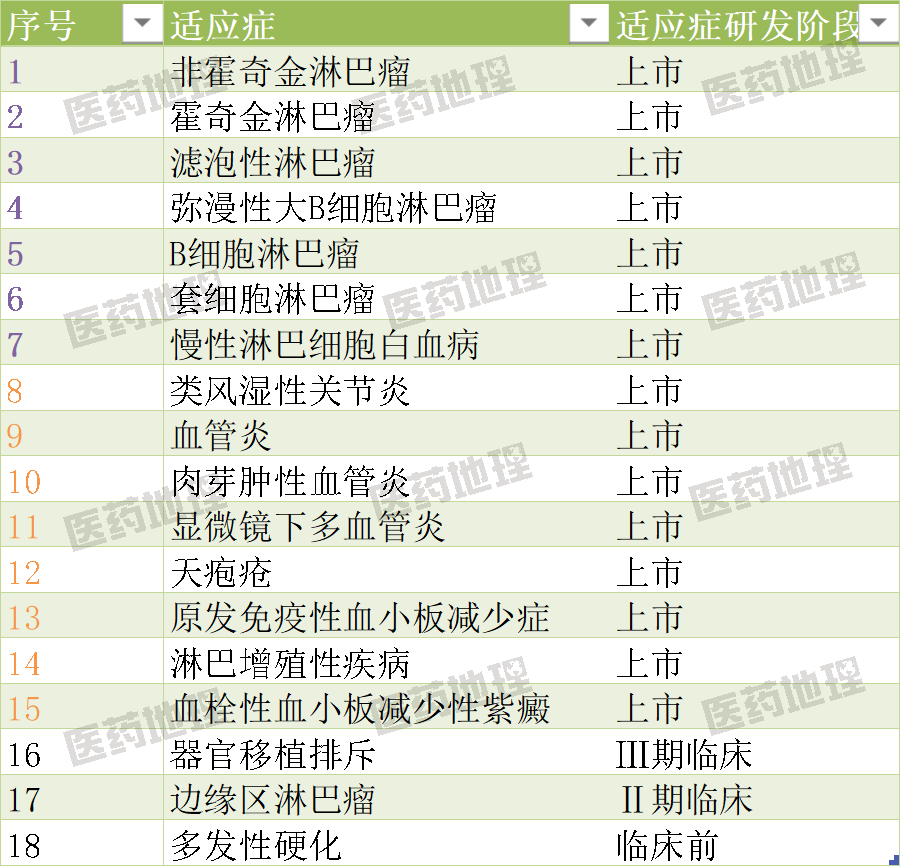
來源:CPM新藥研發(fā)監(jiān)測(cè)數(shù)據(jù)庫
淋巴瘤用來泛指起源于淋巴組織的腫瘤,根據(jù)病理分類,分為霍奇金淋巴瘤(Hodgkin'sLymphoma,HL)和非霍奇金淋巴瘤(Non-Hodgkin'sLymphoma,NHL)兩種,大約80%-90%的淋巴瘤屬于后者。其中大部分的非霍奇金淋巴瘤屬于B細(xì)胞淋巴瘤。最常見的NHL是彌漫性大B細(xì)胞淋巴瘤(DiffuseLarge B Cell Lymphoma, DLBCL)和濾泡性淋巴瘤(FollicularLymphoma,F(xiàn)L)。DLBCL是一種侵襲性B細(xì)胞淋巴瘤,大約30%左右NHL屬于該類型;濾泡性淋巴瘤是一種惰性淋巴瘤,大約25%的NHL屬于該類型。
03 利妥昔單抗的前世
利妥昔單抗由RochePharma(Schweiz)Ltd.公司原研,1997年獲得美國(guó)FDA批準(zhǔn)上市,2000年利妥昔單抗在中國(guó)上市,商品名為美羅華,批準(zhǔn)的適應(yīng)癥為非霍奇金淋巴瘤和慢性淋巴細(xì)胞白血病。值得注意的是,獲批后利妥昔單抗加化療的年花費(fèi)需要20萬以上,國(guó)內(nèi)市場(chǎng)受限于價(jià)格太貴,規(guī)模整體增長(zhǎng)有限。
2017年利妥昔單抗納入國(guó)家醫(yī)保乙類目錄,隨著醫(yī)保的納入,利妥昔的自費(fèi)部分降低到3-4萬左右,市場(chǎng)規(guī)模才開始出現(xiàn)明顯上漲。根據(jù)PDB國(guó)內(nèi)樣本醫(yī)院市場(chǎng)數(shù)據(jù),第一次突破10萬瓶年度銷售量,利妥昔單抗(美羅華)用了16年,納入醫(yī)保后,僅1年時(shí)間美羅華銷售量破20萬瓶,醫(yī)保放量明顯。

來源:CPM新藥研發(fā)監(jiān)測(cè)數(shù)據(jù)庫
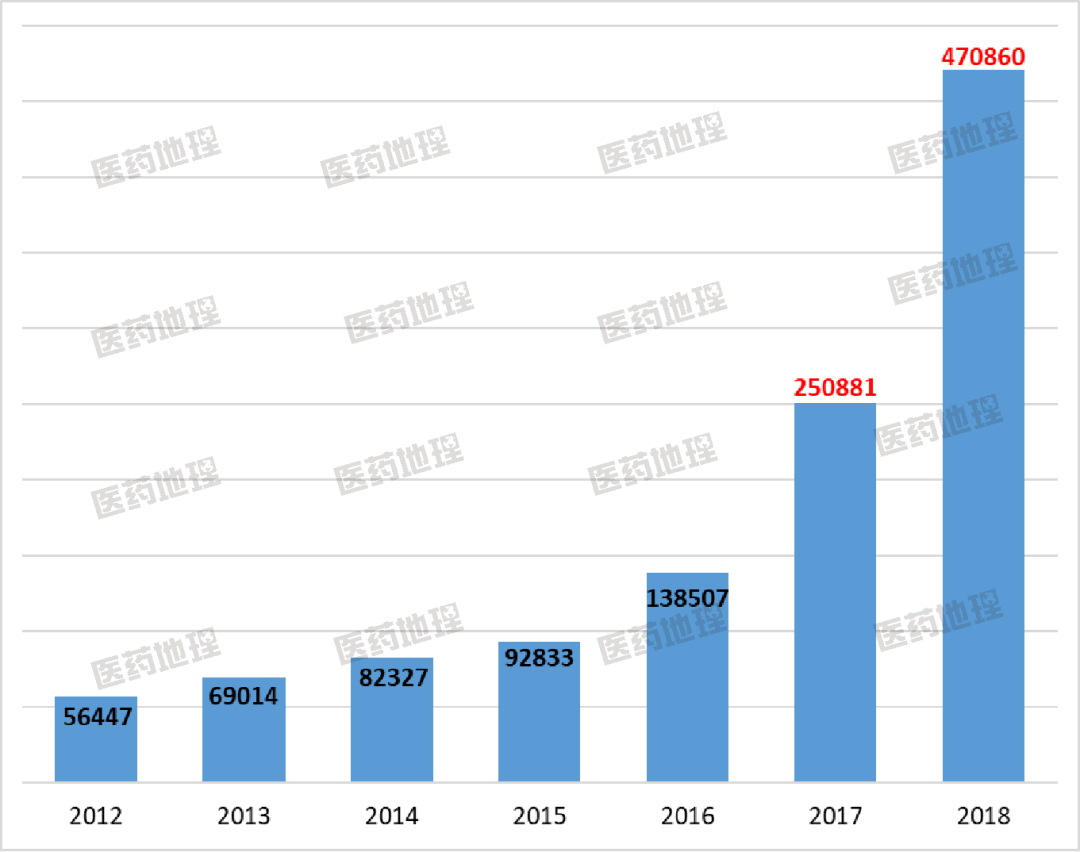
圖1 利妥昔歷年銷售數(shù)量(2012-2018)
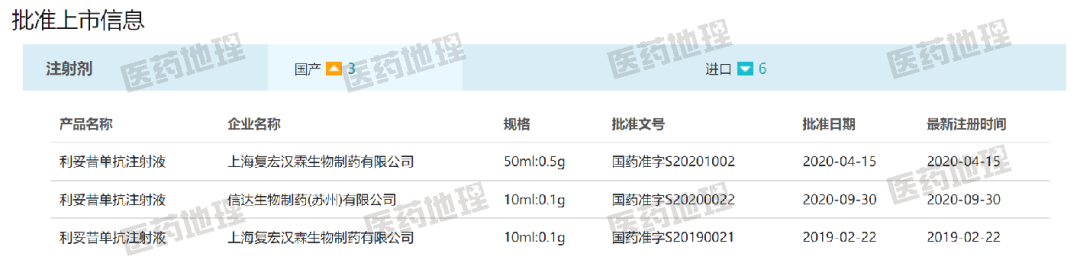
美羅華中國(guó)專利于2013年到期,多家國(guó)內(nèi)外制藥企業(yè)加入其生物類似藥的研發(fā)。國(guó)家藥品監(jiān)督管理局(NMPA)于2019年2月批準(zhǔn)上市的上海復(fù)宏漢霖生物制藥有限公司的利妥昔單抗注射液(漢利康),為國(guó)內(nèi)首個(gè)獲批的利妥昔單抗生物類似藥。
2020年9月底,國(guó)內(nèi)第二款利妥昔單抗獲批上市,商品名達(dá)伯華,來自信達(dá)生物制藥有限公司。根據(jù)CPM新藥研發(fā)監(jiān)測(cè)數(shù)據(jù)庫,正大天晴的利妥昔單抗注射液已經(jīng)處于上市審批中,預(yù)計(jì)近日可獲批。生物類似藥更多由生產(chǎn)成本而非研發(fā)成本決定價(jià)格,較原研藥降幅在30%-50%左右。更低的價(jià)格使得更多患者能夠負(fù)擔(dān),國(guó)內(nèi)利妥昔單抗市場(chǎng)規(guī)模逐年增長(zhǎng)。

來源:CPM新藥研發(fā)監(jiān)測(cè)數(shù)據(jù)庫
04 利妥昔單抗的今生
因?yàn)榧{入醫(yī)保前后利妥昔單抗價(jià)格發(fā)生變動(dòng),不同企業(yè)的生物類似藥和原研藥價(jià)格也不一致,所以我們主要通過利妥昔單抗銷售數(shù)量,再結(jié)合銷售額,對(duì)目前的利妥昔單抗國(guó)內(nèi)市場(chǎng)規(guī)模進(jìn)行分析。如無特別說明,本文所用院端市場(chǎng)數(shù)據(jù)均來自PDB綜合數(shù)據(jù)庫,銷售數(shù)量以最小單位1瓶為計(jì)量單位。
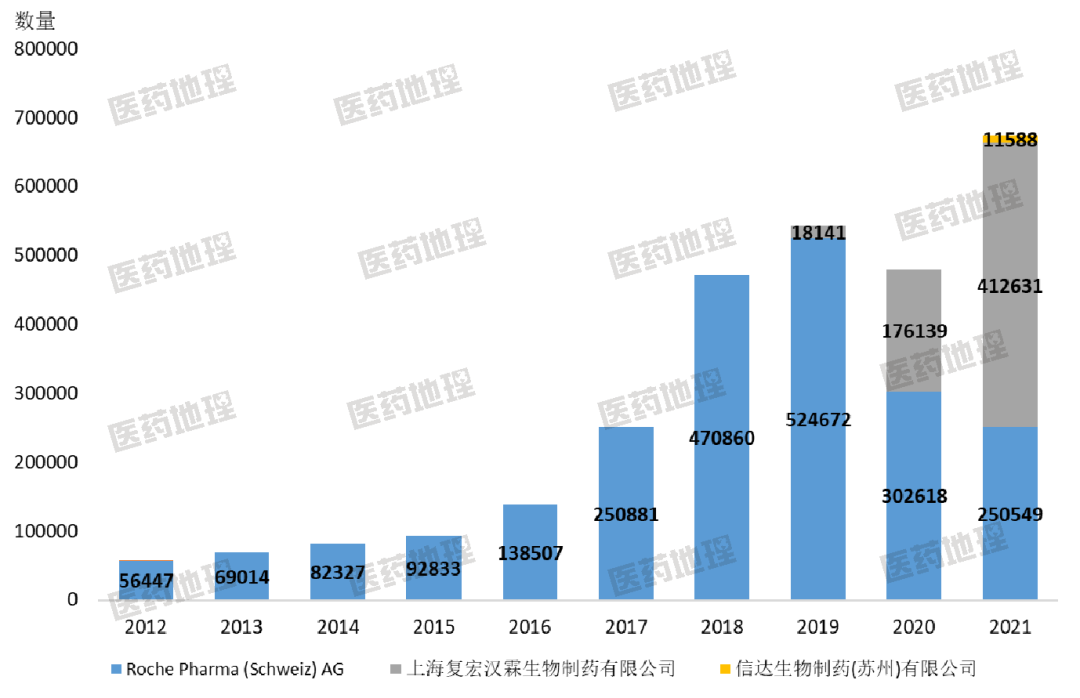
圖2 利妥昔單抗各生產(chǎn)企業(yè)歷年銷售數(shù)量
通過圖2可以看到,復(fù)宏漢霖的利妥昔單抗進(jìn)入市場(chǎng)后放量很快。從2019年到2021年,僅僅兩年時(shí)間,漢利康的銷售數(shù)量就超過了美羅華。漢利康的市場(chǎng)份額一部分是搶占了原來美羅華的市場(chǎng),另一部分則是通過降價(jià)放量開拓了新的市場(chǎng)。因?yàn)榕c原研藥使用相同通用名,所以漢利康獲批后可以直接進(jìn)入醫(yī)保。
從一些公開數(shù)據(jù)來看,漢利康獲批上市后,以1640元/支的價(jià)格陸續(xù)在廣西、貴州等地掛網(wǎng),該價(jià)格相較美羅華的醫(yī)保價(jià)格已有約30%的降幅。2019年7月30日,獲批5個(gè)月后,復(fù)宏漢霖又將利妥昔單抗(100mg/10ml)中標(biāo)價(jià)格由1640元/瓶調(diào)整為1398元/瓶,降幅達(dá)14.8%。復(fù)宏漢霖再將羅氏一軍,通過價(jià)格戰(zhàn)實(shí)現(xiàn)了從老二到老大的逆襲。
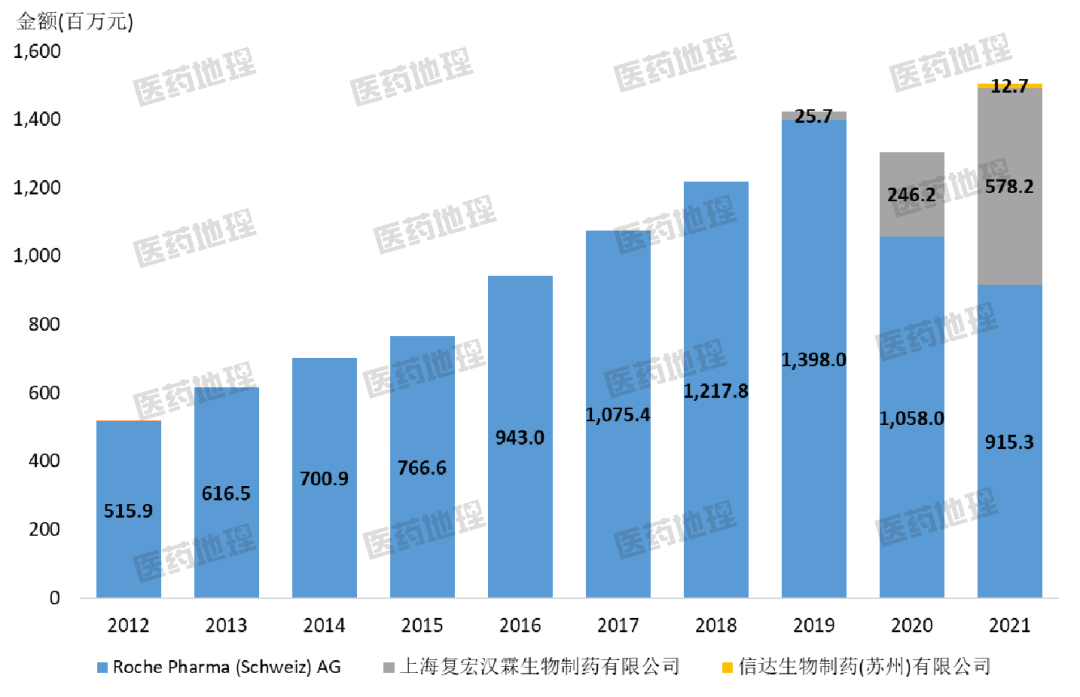
圖3 利妥昔單抗各生產(chǎn)企業(yè)歷年銷售增長(zhǎng)
不過由圖3可以看出,在整體銷售額上,羅氏的美羅華目前還是穩(wěn)居第一。復(fù)宏漢霖目前僅完成了數(shù)量上的逆襲,能否由量變產(chǎn)生質(zhì)變,還需要時(shí)間和市場(chǎng)進(jìn)一步驗(yàn)證。
信達(dá)生物的達(dá)伯華由于獲批較晚,目前所占據(jù)的市場(chǎng)份額有限。不過在上周剛剛結(jié)束的廣東聯(lián)盟帶量采購(gòu)中,利妥昔單抗納入集采,信達(dá)生物力壓羅氏和復(fù)宏漢霖,以885.8元/瓶的誠(chéng)意奪得擬中選名額。市場(chǎng)總是先來的吃肉,后來的喝湯,由于患者粘性和醫(yī)生處方習(xí)慣,藥品市場(chǎng)更是如此。某種程度上,集采給了企業(yè)重新洗牌的機(jī)會(huì),信達(dá)生物此舉也算是背水一戰(zhàn),能否有所突破,我們拭目以待。
從第一個(gè)抗腫瘤單抗上市到生物類似藥第一次納入集采,已經(jīng)過去了20多年,這期間,許多原研單抗和生物類似藥陸續(xù)上市,為腫瘤患者延長(zhǎng)了生命,帶來了治愈的希望。我們期待未來有更多新藥和仿制藥研發(fā)上市,將國(guó)民健康再提升一個(gè)新臺(tái)階。



