國家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)日前發(fā)布《關(guān)于公開征求<化學(xué)仿制藥參比制劑目錄(第五十九批)>(征求意見稿)意見的通知》,新參比制劑納入尚未發(fā)布品種69個(gè)、增補(bǔ)品種32個(gè)、未通過品種27個(gè)、再議品種目錄2個(gè)。
值得關(guān)注的是,新增69個(gè)品規(guī)的參比名單中,包含國內(nèi)上市的原研創(chuàng)新藥物32個(gè),其中出現(xiàn)了國產(chǎn)1類新藥的身影,諸如貝達(dá)藥業(yè)的??颂婺?,正大天晴的安羅替尼,麗珠集團(tuán)的艾普拉唑,微芯生物的西達(dá)本胺,以及恒瑞的艾瑞昔布、阿帕替尼、吡咯替尼等在內(nèi)的諸多重磅“明星”品種赫然在列。
審評(píng)審批制度改革以來,中國醫(yī)藥產(chǎn)業(yè)創(chuàng)新升級(jí)進(jìn)入新階段。相對(duì)過去的參比制劑目錄多為海外跨國企業(yè)的原研品種,本次的征求意見稿公布在業(yè)內(nèi)看來無疑有著特殊的意義。
業(yè)內(nèi)人士指出,一大批本土醫(yī)藥企業(yè)中國原創(chuàng)新藥涌現(xiàn),極大改善了藥物可及性,讓患者得到了更多獲益;另一方面,監(jiān)管部門將這些中國原創(chuàng)新藥納入?yún)⒈戎苿瑹o異于廣發(fā)“英雄帖”,伴隨這些品種未來核心專利過期,勢必吸引更多仿制藥加入競爭,中國原創(chuàng)新藥也勢必面對(duì)“專利懸崖”帶來的市場考驗(yàn)。
政策廣發(fā)“英雄帖”
“專利懸崖”正在逼近
上世紀(jì)末本世紀(jì)初,我國醫(yī)藥產(chǎn)業(yè)高速發(fā)展,涌現(xiàn)出一批1類創(chuàng)新藥和2類改良型新藥。事實(shí)上,中國新藥是中國醫(yī)藥產(chǎn)業(yè)發(fā)展的重要成果,為群眾用藥提供了便利和保障。
在鼓勵(lì)創(chuàng)新藥同時(shí),仿制藥研發(fā)同樣是滿足公眾監(jiān)管需求,改善藥物負(fù)擔(dān)的重要一環(huán)。根據(jù)《化學(xué)藥品注冊(cè)受理審查指南(試行)第一部分 注冊(cè)分類1、2、5.1類》規(guī)定,我國的新藥要成為參比制劑,應(yīng)當(dāng)“經(jīng)國家藥品監(jiān)管部門評(píng)估確認(rèn)”。
今年3月,兩會(huì)期間,全國人大代表、華海藥業(yè)總裁陳保華公開表示,應(yīng)當(dāng)加快修改完善現(xiàn)行有關(guān)政策,賦予中國新藥參比制劑地位,為仿制中國新藥創(chuàng)造前提條件,并鼓勵(lì)仿制藥上市,從而改變由于無法仿制導(dǎo)致一個(gè)品種長期獨(dú)占市場的局面。
不難看出,對(duì)于中國原創(chuàng)新藥的仿制工作,已經(jīng)引起越來越多的行業(yè)關(guān)注,監(jiān)管方面也給予了高度重視。相比起此前的參比制劑目錄,本次發(fā)布的最新一批參比制劑目錄,將中國原創(chuàng)新藥列入?yún)⒈戎苿?,有著非常鮮明的政策導(dǎo)向。
在此次新增的參比名單中,共列入的中國原研新藥14個(gè)品種,22個(gè)品規(guī),涉及12家原研企業(yè),恒瑞醫(yī)藥入選品種最多,達(dá)到3個(gè)。另外11家企業(yè)各有1個(gè)。
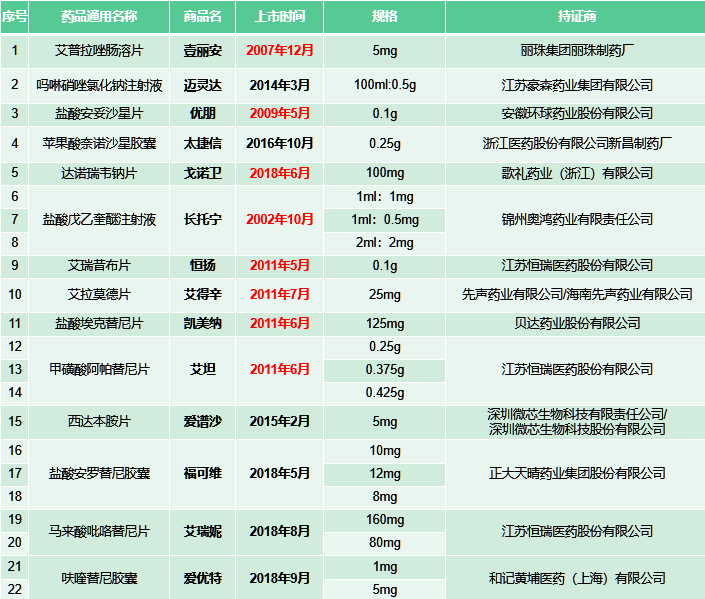
上述品種既有我國第一個(gè)具有自主知識(shí)產(chǎn)權(quán)的1.1類氟喹諾酮類抗菌藥鹽酸安妥沙星等“明星”品種,也有不乏年銷售超十億的大品種。以貝達(dá)藥業(yè)的埃克替尼為例,在公司公布的2021年年報(bào)中,提及其銷售額連續(xù)6年突破10億元,毫無疑問的核心“現(xiàn)金流”品種;正大天晴的安羅替尼更是細(xì)分市場的頭部品種,2020年銷售額已經(jīng)達(dá)到40億元。
這一情況也與行業(yè)統(tǒng)計(jì)的銷售數(shù)據(jù)吻合。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2021年國產(chǎn)1類新藥銷售TOP20合計(jì)銷售規(guī)模超過400億元,其中有19個(gè)銷售額達(dá)10億元及以上(4款突破30億元)。

值得關(guān)注的是,在上述中國原研新藥中,上市時(shí)間較早的有錦州奧鴻藥業(yè)的鹽酸戊乙奎醚注射液,麗珠集團(tuán)的艾普拉唑腸溶片,恒瑞醫(yī)藥的艾瑞昔布和甲磺酸阿帕替尼,貝達(dá)藥業(yè)的埃克替尼,先聲藥業(yè)的艾拉莫德片等品種,部分產(chǎn)品的核心專利的保護(hù)期已經(jīng)得到市場關(guān)注:
貝達(dá)藥業(yè)在投資者平臺(tái)上透露,埃克替尼的通式化合物專利將于2023年3月到期;不過,除通式化合物專利外,??颂婺徇€受晶型、制備方法等多方面專利保護(hù)。
微芯生物在投資者互動(dòng)平臺(tái)表示,西達(dá)本胺的化合物專利到期時(shí)間是2023年7月;目前,西達(dá)本胺已在全球獲得23項(xiàng)發(fā)明專利授權(quán),構(gòu)成了完善的專利保護(hù)網(wǎng)絡(luò),化合物專利到期后其他專利依舊能夠?qū)ξ鬟_(dá)本胺形成良好的專利保護(hù)。
市場人士指出,據(jù)國家醫(yī)保局在多輪集采中總結(jié)的經(jīng)驗(yàn),適合集采的品種要符合“臨床使用量較大、采購金額較高、市場競爭較為充分”這三個(gè)條件,而在此前行業(yè)內(nèi)部流出的未來五年內(nèi)完成集采500個(gè)品種名單中,諸如??颂婺?、艾普拉唑、阿帕替尼、艾瑞昔布等核心專利即將過期的重磅大品種,已經(jīng)得到了帶量采購“關(guān)注”。
“以往提到‘專利懸崖’更多是針對(duì)跨國藥企,品牌原研藥過期之后由于仿制藥在細(xì)分領(lǐng)域的價(jià)格競爭,將引發(fā)品牌藥價(jià)格大幅下滑;如今中國原創(chuàng)新藥被列為參比制劑,政策廣發(fā)‘英雄帖’鼓勵(lì)仿制,未來的‘專利懸崖’將不會(huì)只發(fā)生在進(jìn)口藥,中國原創(chuàng)新藥也將面對(duì)競爭壓力。”
高水平創(chuàng)新藥仍具優(yōu)勢
專利攻防戰(zhàn)悄然打響
事實(shí)上,醫(yī)藥產(chǎn)業(yè)對(duì)研發(fā)和專利保護(hù)具有高度的依賴性。我國自1993年1月1日起開始對(duì)化學(xué)領(lǐng)域發(fā)明的產(chǎn)品專利進(jìn)行保護(hù),原研新藥將會(huì)有20年的專利保護(hù)期。在這期間,如果有其他企業(yè)進(jìn)行仿制,將會(huì)付出高額代價(jià)。
今年6月1日,2020年新修訂的《中華人民共和國專利法》正式施行。其中第四十二條明定了影響醫(yī)藥行業(yè)創(chuàng)新的關(guān)鍵內(nèi)容:
為補(bǔ)償新藥上市審評(píng)審批占用的時(shí)間,對(duì)在中國獲得上市許可的新藥相關(guān)專利,國家專利行政部門應(yīng)專利權(quán)人的請(qǐng)求給予專利權(quán)期限補(bǔ)償,補(bǔ)償期限不超過5年,新藥批準(zhǔn)上市后總有效專利權(quán)期限不超過14年。
一般而言,原研藥具有療效好、市場規(guī)模大、價(jià)格昂貴的特點(diǎn)。而原研藥專利到期后,將會(huì)有質(zhì)量與療效一致,但價(jià)格大幅降低的仿制藥上市。
設(shè)定專利保護(hù)期也是為了鼓勵(lì)醫(yī)藥創(chuàng)新,因?yàn)樵兴幵谘邪l(fā)階段投入了大量的資金,因此需要一段時(shí)間的專利保護(hù),使其能獨(dú)享市場。為進(jìn)一步提高藥物可及性,改善醫(yī)療負(fù)擔(dān),國家鼓勵(lì)藥企在專利保護(hù)期過后對(duì)原研新藥進(jìn)行仿制,引入競爭,大幅度降低藥價(jià)。
對(duì)于第一個(gè)沖進(jìn)市場的仿制藥,即首仿藥,我國藥改政策也給予了較大的鼓勵(lì)。不僅在審評(píng)審批制度上給予方便,由國家藥品監(jiān)督管理局、國家知識(shí)產(chǎn)權(quán)局組織制定《藥品專利糾紛早期解決機(jī)制實(shí)施辦法(試行)》發(fā)布并施行,確定對(duì)于專利挑戰(zhàn)成功的首仿藥,將獲得12個(gè)月的市場獨(dú)占期。
業(yè)界認(rèn)為,中國創(chuàng)新藥在某些疾病領(lǐng)域相繼出現(xiàn)從0到1的重大突破,完善相關(guān)法律法規(guī)志在保護(hù)有價(jià)值的創(chuàng)新,未來原創(chuàng)專利藥獲得保護(hù)期延長的加持,而創(chuàng)新水平不足的藥品專利,即使獲得了注冊(cè)也無法起到護(hù)城河的作用,很有可能會(huì)被專利挑戰(zhàn)所擊退。
換而言之,藥品專利“爭奪戰(zhàn)”已悄然打響,將賦予創(chuàng)新藥與仿制藥企業(yè)雙向的機(jī)遇與挑戰(zhàn)。專利挑戰(zhàn)若能成功,將為國內(nèi)企業(yè)的仿制藥上市和正常銷售掃清障礙。
以治療類風(fēng)關(guān)的JAK抑制劑托法替布為例。托法替布由輝瑞開發(fā),正大天晴和齊魯制藥是國內(nèi)開發(fā)托法替布仿制藥速度最快的2家公司。2018-2019年,正大天晴和齊魯制藥對(duì)托法替布的2項(xiàng)關(guān)鍵專利(化合物和晶型專利)提出無效請(qǐng)求。原專利復(fù)審委員會(huì)分別于2018年8月對(duì)化合物專利、2019年11月對(duì)晶型專利作出“全部無效”決定。這提前為兩家公司仿制藥上市后的正常銷售掃清專利障礙。
今年4月15日,北京知識(shí)產(chǎn)權(quán)法院公開宣判原告中外制藥株式會(huì)社訴被告溫州海鶴藥業(yè)有限公司確認(rèn)是否落入專利權(quán)保護(hù)范圍糾紛一案,法院經(jīng)審理認(rèn)為,涉案仿制藥并未落入涉案專利權(quán)的保護(hù)范圍,判決駁回原告的訴訟請(qǐng)求。據(jù)悉,該案為新《專利法》實(shí)施以來全國首例藥品專利鏈接訴訟案件,被行業(yè)視作“專利鏈接第一案”
行業(yè)普遍認(rèn)為,專利挑戰(zhàn)的高壁壘和知識(shí)產(chǎn)權(quán)的復(fù)雜性決定了挑戰(zhàn)結(jié)果的不確定性。
數(shù)據(jù)也印證了這一判斷。國家知識(shí)產(chǎn)權(quán)局的專利無效宣告決定初步檢索發(fā)現(xiàn),2020年國家知識(shí)產(chǎn)權(quán)局公布的無效宣告決定號(hào)數(shù)量為26件,與此前兩年(2018-2019)基本持平(分別為29件和27件),在近兩年(2019-2020)的無效宣告決定中,全部無效決定都超過半數(shù)(分別為59%和54%)。
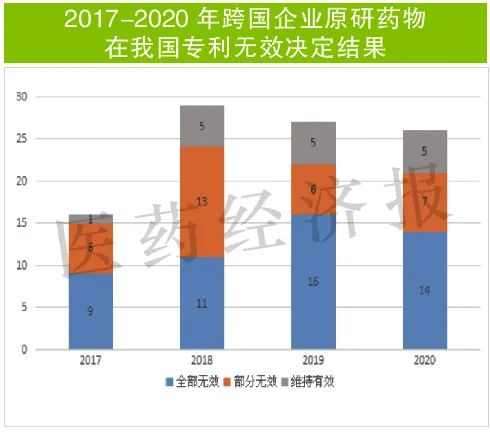
專家表示,創(chuàng)新藥延長了五年專利窗口,不知能不能對(duì)沖帶量采購、醫(yī)??刭M(fèi)的影響,但可以肯定,沒有真正意義的創(chuàng)新藥物會(huì)越來越難過。只有創(chuàng)新藥可利用專利期延長帶來利潤增長。
我國藥品專利鏈接制度一方面是從鼓勵(lì)藥物創(chuàng)新的角度,授予創(chuàng)新藥專利保護(hù)期延長以充分保護(hù);同時(shí),提高藥品可及性的角度上,鼓勵(lì)仿制藥利用規(guī)則,通過專利挑戰(zhàn)以及專利規(guī)避盡快合法地提前上市,目的是平衡創(chuàng)新藥和仿制藥的發(fā)展,以鼓勵(lì)醫(yī)藥行業(yè)的創(chuàng)新發(fā)展。
參比制劑目錄逐步更新,未來將有更多中國原創(chuàng)新藥成為“參比制劑”,也將有更多1類、2類新藥成為仿制藥“圍獵”的目標(biāo)。面對(duì)醫(yī)保談判、帶量采購等支付端的市場結(jié)構(gòu)性變化,無論是創(chuàng)新藥還是仿制藥,產(chǎn)品市場生命周期管理如今已經(jīng)成為決定產(chǎn)品成敗的重要因素。



