1月27日訊
12款新藥上市有進展!齊魯、武田、AZ……
1月9日-1月22日期間,12個新藥(21個受理號)的上市申請有審評審批狀態(tài)更新。其中,齊魯制藥的奧氮平口溶膜、百濟神州的替雷利珠單抗注射液、綠葉制藥的注射用利培酮緩釋微球獲批生產(chǎn);武田的美阿沙坦鉀片、阿斯利康的布地奈德福莫特羅粉吸入劑(Ⅱ)、Helsinn的鹽酸帕洛諾司瓊注射液、協(xié)和發(fā)酵麒麟的布羅舒單抗注射液獲批進口;默沙東的泊沙康唑注射液及艾格列凈片、我武生物的黃花蒿花粉變應原舌下滴劑……5個藥品的上市申請注冊辦理狀態(tài)變更為“在審批”。
(1.09-1.22)新藥上市申請審評審批狀態(tài)更新
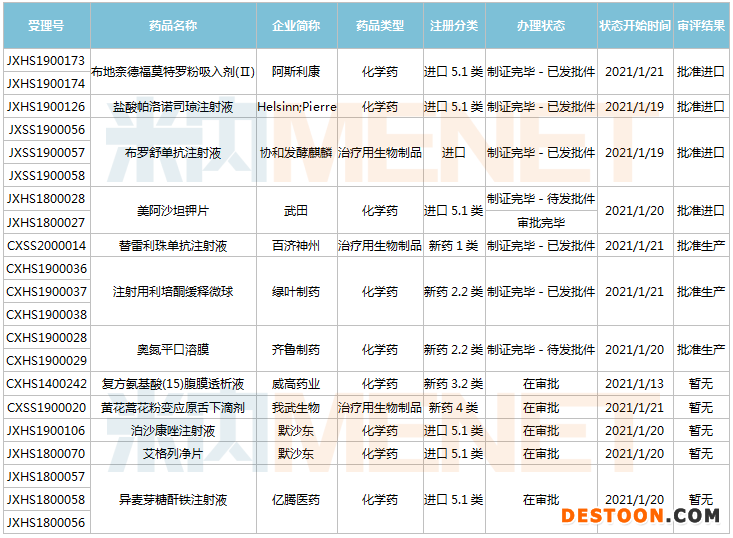
image.png美阿沙坦鉀片是武田自主研發(fā)的一款血管緊張素II受體阻滯劑,用于治療原發(fā)性高血壓。該產(chǎn)品最早于2011年獲FDA批準上市,2019年全球銷售額為767億日元。米內網(wǎng)數(shù)據(jù)顯示,2019年中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端抗高血壓藥物的銷售額約為591億元,同比增長7.2%。武田的美阿沙坦鉀片上市銷售后將分羹國內抗高血壓藥市場。
2類改良型新藥奧氮平口溶膜是齊魯制藥獲批的首款口溶膜劑,也是國內第二款口溶膜劑。奧氮平是抗精神病藥,米內網(wǎng)數(shù)據(jù)顯示,2019年中國公立醫(yī)療機構終端奧氮平銷售額超過40億元??谌苣な且环N新型藥物傳遞系統(tǒng),其臨床優(yōu)勢在于不需用水送服,放在舌上即溶,且黏附后不易吐出,劑量準確,尤其適合兒童和吞咽困難的患者。此外,齊魯制藥還有4款口溶膜劑的上市申請在審中。
鹽酸帕洛諾司瓊注射液是Helsinn開發(fā)的選擇性5-羥色胺3(5-HT3)受體拮抗劑,是第一個獲準用于預防遲發(fā)性化療所致惡心、嘔吐的5-HT3受體拮抗劑。米內網(wǎng)數(shù)據(jù)顯示,2019年中國公立醫(yī)療機構終端鹽酸帕洛諾司瓊注射液銷售額接近15億元。目前國內市場該產(chǎn)品已有13家藥企獲批仿制。
替雷利珠單抗注射液是百濟神州自主研發(fā)的抗PD-1抗體藥物,此次獲批用于晚期鱗狀非小細胞肺癌(NSCLC)的一線治療,是首個獲批用于肺鱗癌的國產(chǎn)PD-1。此前,替雷利珠單抗已獲批用于經(jīng)典型霍奇金淋巴瘤及尿路上皮癌的治療。2020年12月28日,替雷利珠單抗進入國家醫(yī)保談判目錄。1月12日,百濟神州宣布與諾華就替雷利珠單抗達成合作與授權協(xié)議,首付款高達6.5億美元,成為迄今為止首付金額最高的中國新藥授權合作項目,總交易金額超過22億美元。
13款新藥申請上市!羅欣、百濟神州、奧賽康……
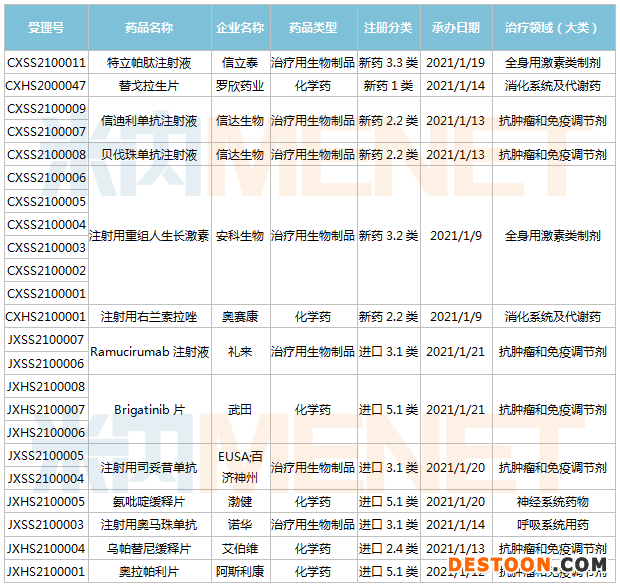
1月9日-1月22日期間,13個新藥(23個受理號)上市申請獲得CDE承辦。其中7個品種(11個受理號)為進口新藥,6個品種(12個受理號)為國產(chǎn)新藥。從藥物類型看,化學藥有8個,治療用生物制品有15個。
(1.09-1.22)獲承辦的國產(chǎn)/進口新藥上市申請
羅欣藥業(yè)的1類新藥替戈拉生片是鉀離子競爭性酸阻滯劑類藥物(P-CAB),其抑制酸分泌的作用機制為競爭性結合壁細胞內H+/K+-ATP酶(質子泵)的鉀離子結合部位。與質子泵抑制劑(PPI)不同,P-CAB可直接抑制H+/K+-ATP酶,無需在強酸環(huán)境下活化。此前,羅欣藥業(yè)與韓國CJ達成協(xié)議,獲得替戈拉生中國境內開發(fā)、生產(chǎn)及商業(yè)化權益。替戈拉生片是國內第二款報產(chǎn)的P-CAB,國內首個獲批的P-CAB為武田的富馬酸伏諾拉生片。
注射用司妥昔單抗是百濟神州引進的IL-6抑制劑,用于治療人類免疫缺陷病毒(HIV)陰性和人類皰疹病毒8(HHV-8)陰性的多中心卡斯特曼病成年患者。該產(chǎn)品上市申請于1月20日獲CDE受理,目前已納入優(yōu)先審評。
阿斯利康的奧拉帕利片于2018年8月首次在國內獲批用于治療卵巢癌,是國內首個獲批的小分子靶向PARP抑制劑。此次奧拉帕利片申請上市的適應癥為前列腺癌,1月21日獲納入擬優(yōu)先審評。米內網(wǎng)數(shù)據(jù)顯示,2019年阿斯利康和默沙東的奧拉帕利片銷售額合計有16.42億美元。
揚子江、先聲、華海……41個新藥獲批臨床
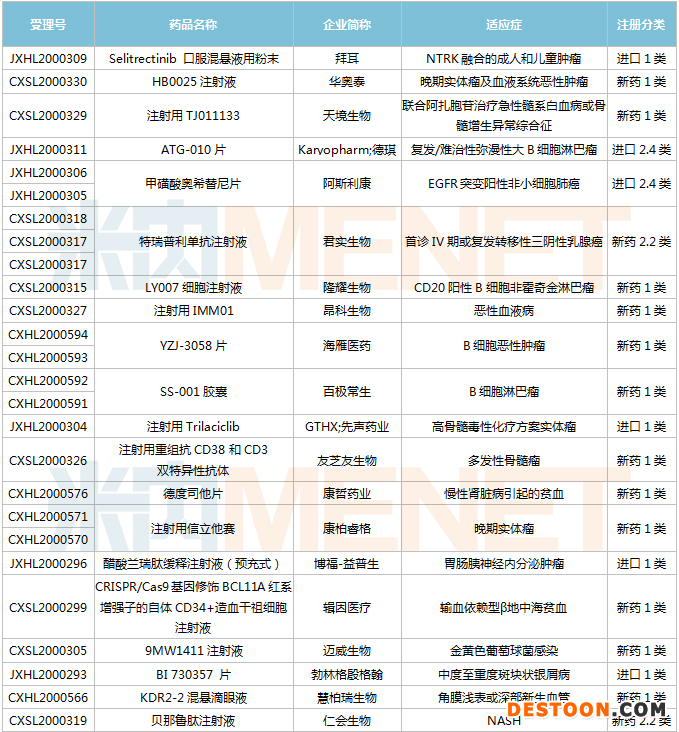
1月9日-1月22日期間,41個新藥(涉及55個受理號)獲得臨床試驗默示許可。其中,26個品種(34個受理號)為國產(chǎn)新藥,15個品種(21個受理號)為進口新藥。從藥品類型看,化學藥有24個、治療用生物制品有17個。26個國產(chǎn)新藥中,1類新藥有20個。
(1.09-1.22)獲批臨床的國產(chǎn)/進口新藥
1月21日,CDE官網(wǎng)顯示,華海藥業(yè)子公司華奧泰的1類新藥HB0025注射液獲得臨床試驗默示許可。2020年12月,HB0025注射液獲美國FDA批準開展臨床試驗,成為全球首個批準進入臨床試驗、能同時阻斷PD-1/PD-L1和VEGF/VEGFR這兩條信號通路的雙特異性融合蛋白。目前尚無同時阻斷PD-1/PD-L1和VEGF/VEGFR這兩條信號通路的藥物上市,康方生物開發(fā)的靶向PD-1和VEGF的雙特異性抗體AK112正處于臨床研究階段。
注射用Trilaciclib是先聲藥業(yè)與G1 Therapeutics(GTHX.US)聯(lián)合申報的1類新藥,擬用于小細胞肺癌患者因化療引起的骨髓抑制。注射用Trilaciclib是一款短效的CDK4/6抑制劑,曾獲FDA授予的優(yōu)先審評資格和突破性療法認定。2020年8月,先聲藥業(yè)以高達1.7億美元從GTHX引進,獲得了該產(chǎn)品在大中華地區(qū)所有適應癥的開發(fā)和商業(yè)化權益。
康方生物是專注于開發(fā)創(chuàng)新抗體新藥的生物制藥公司,1類新藥AK119注射液為CD73單克隆抗體,獲批臨床的適應癥為特發(fā)性肺纖維化(IPF)。截至目前,康方生物已有6款1類新藥獲批臨床。
揚子江藥業(yè)全資子公司上海海雁醫(yī)藥的1類新藥YZJ-3058片擬用于治療B細胞惡性腫瘤。貝達藥業(yè)的1類新藥BPI-23314片擬用于血液瘤、乳腺癌以及肺癌等腫瘤的治療。恒瑞醫(yī)藥的1類新藥HRS4800片擬用于急、慢性疼痛,目前全球無同靶點藥物上市。
東陽光藥、齊魯、豪森……54個新藥臨床申請獲承辦
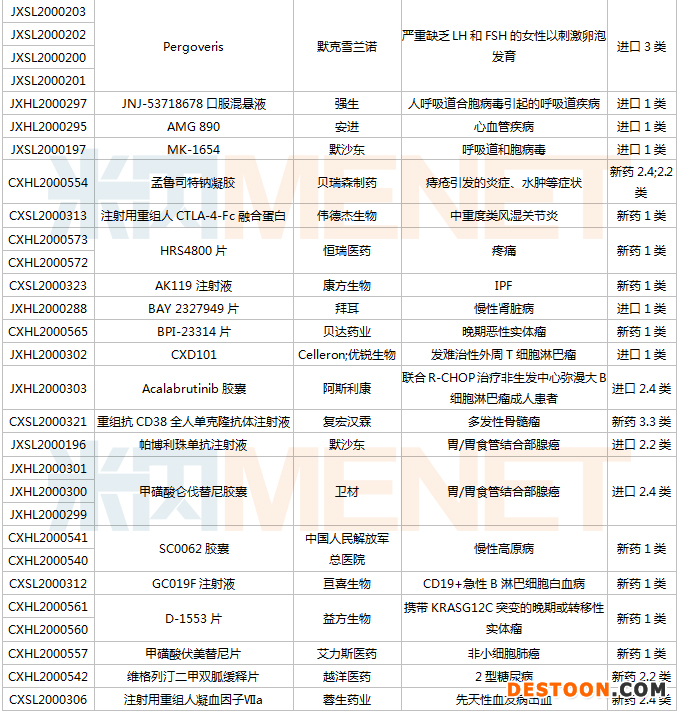
1月9日-1月22日期間,54個新藥(涉及82個受理號)的臨床申請獲CDE承辦受理。其中,38個品種(60個受理號)為國產(chǎn)新藥,16個品種(22個受理號)為進口新藥。從藥物類型看,化學藥有33個、治療用生物制品有21個。38個國產(chǎn)新藥中,1類創(chuàng)新藥有22個。
(1.09-1.22)獲承辦的國產(chǎn)/進口新藥臨床申請
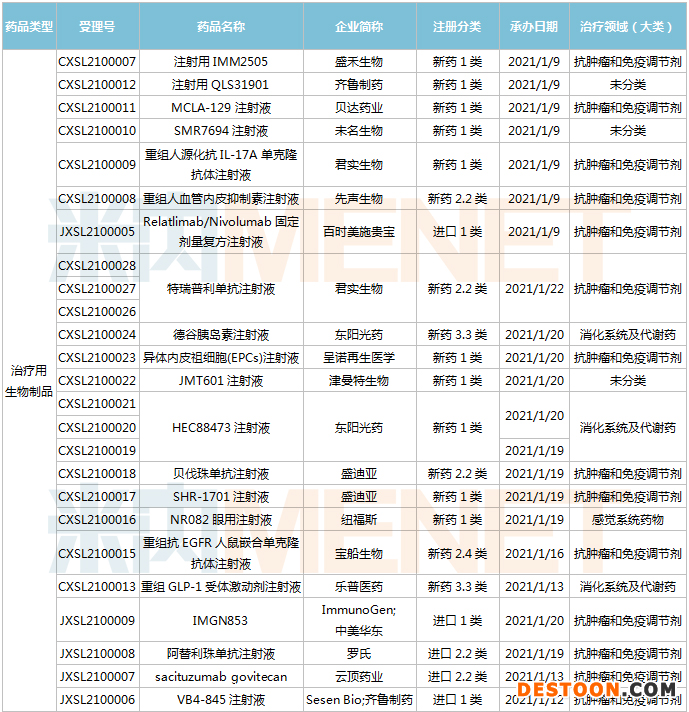
image.pngimage.png華東醫(yī)藥的1類新藥IMGN853(Mirvetuximab Soravtansine,簡稱“MIRV”)是全球首個針對FRα陽性卵巢癌的抗體偶聯(lián)藥物(ADC)在研藥物,用于治療葉酸受體高表達的鉑類耐藥卵巢癌,屬于全球首創(chuàng)產(chǎn)品(First-in-class)。2020年10月20日,中美華東與美國ImmunoGen達成合作協(xié)議,獲得ImmunoGen美國臨床III期在研產(chǎn)品MIRV在大中華區(qū)的獨家臨床開發(fā)及商業(yè)化權益,此筆交易首付款和里程碑付款最高可達3.05億美元。
信立泰的1類新藥SAL0104膠囊為凝血因子XIa抑制劑,擬申請適應癥為預防、治療血栓性 疾病。相較同類產(chǎn)品,凝血因子XIa抑制劑在降低血栓發(fā)病率的同時,兼具出血風險小的特點。近年來信立泰深耕心腦血管領域,在研創(chuàng)新藥還包括SAL007、恩那司他片、S086及SAL092片等。米內網(wǎng)數(shù)據(jù)顯示,2019年中國公立醫(yī)療機構終端心血管系統(tǒng)藥物銷售額超過1000億元。SAL0104膠囊上市后,將進一步滿足潛在的臨床需求,豐富公司心腦血管領域的創(chuàng)新產(chǎn)品管線。
恒瑞醫(yī)藥有3款1類新藥申報臨床,包括HRS2543片、SHR8008膠囊及SHR-1701注射液。東陽光藥、復星醫(yī)藥、微芯生物均有1款1類新藥申報臨床,分別為HEC88473注射液、YP01001膠囊及西奧羅尼膠囊。YP01001膠囊為創(chuàng)新型小分子化學藥,擬用于治療晚期實體瘤(肝癌、胃癌等)。西奧羅尼膠囊非首次申報臨床,其25mg規(guī)格已進入II期臨床試驗,適應癥為鉑難治或鉑耐藥復發(fā)卵巢癌。
數(shù)據(jù)來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫、CDE、公司公告
注:數(shù)據(jù)統(tǒng)計時間段為1月9日-1月22日,按藥品名稱統(tǒng)計(不含預防用生物制品、體外診斷試劑等,不含補充申請),如有疏漏,歡迎指正!



