3月19日訊 日前,石藥集團(tuán)公布2020年業(yè)績,全年收入249.42億元,同比增長12.8%;凈利潤51.6億元,同比增長38.9%,突破50億元大關(guān)。成藥業(yè)務(wù)中,抗腫瘤、心血管藥分別增長29.0%和61.9%,創(chuàng)新藥產(chǎn)品再創(chuàng)佳績,集采中標(biāo)帶來新的利潤增長源。目前石藥集團(tuán)已有43個品種過評(16個為首家),18個品種中標(biāo)國采。研發(fā)費用大幅增加至28.9億元,同比增長44.5%,目前集團(tuán)在研項目約300項,小分子創(chuàng)新藥、大分子創(chuàng)新藥、新型制劑齊發(fā)力,多個新藥處于III期臨床/上市申請階段。
凈利潤突破50億!抗腫瘤、心血管藥大豐收
2016-2020年石藥集團(tuán)業(yè)績情況(單位:億元)
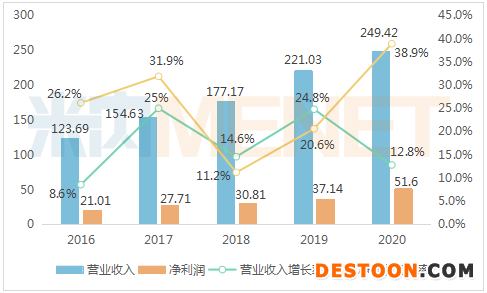
3月15日,石藥集團(tuán)公布2020年業(yè)績,集團(tuán)全年收入249.42億元,同比增長12.8%;凈利潤增加38.9%至51.6億元,較2019年有明顯的躍升。其中,成藥業(yè)務(wù)收入204.05億元,同比增長13.8%;抗生素及其它原料收入13.73億元,同比增長30.4%;功能食品及其它收入約為13.06億元,同比增長9.5%;維生素C原料收入18.59億元,同比下滑3.2%。
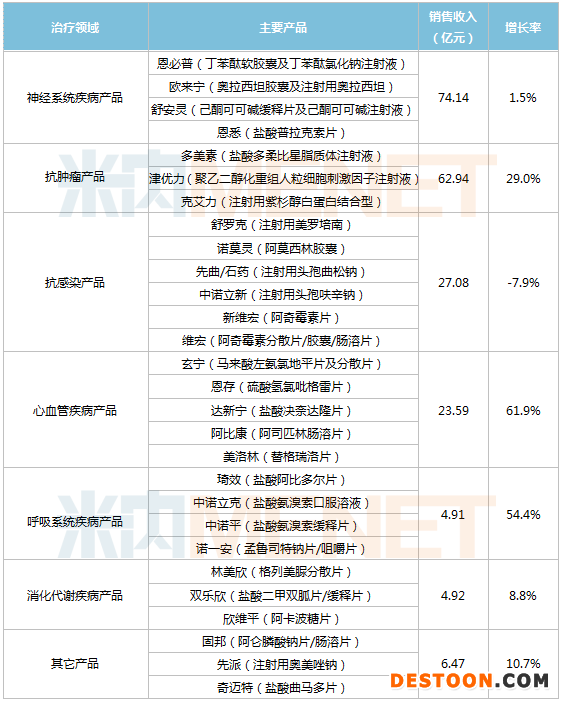
成藥業(yè)務(wù)是石藥集團(tuán)業(yè)績增長的主要動力。從藥品治療領(lǐng)域看,神經(jīng)系統(tǒng)疾病產(chǎn)品和抗腫瘤產(chǎn)品是石藥集團(tuán)成藥業(yè)務(wù)的兩大支柱,銷售收入分別為74.14億元和62.94億元。心血管疾病產(chǎn)品、呼吸系統(tǒng)疾病產(chǎn)品銷售收入大漲,同比分別增長61.9%和54.4%。
創(chuàng)新藥產(chǎn)品繼續(xù)保持高速增長,恩必普、多美素、津優(yōu)力及克艾力等重磅品種再次創(chuàng)造了驕人的銷售成績。其中,多美素增長41.3%,津優(yōu)力增長37.3%,玄寧增長36.8%,恩必普增長17.4%,克艾力增長16.4%。
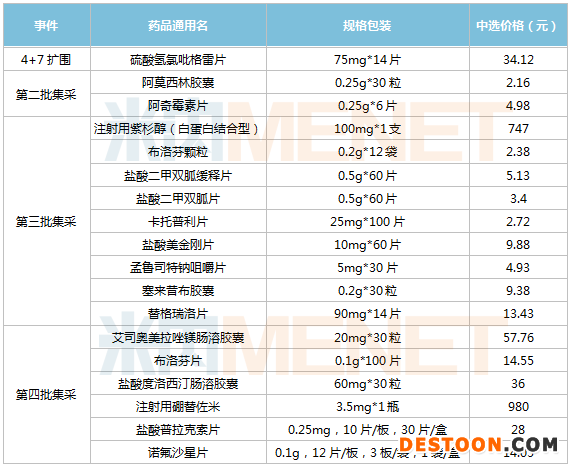
值得關(guān)注的是,帶量采購成為了石藥集團(tuán)新的利潤增長源。28個主要產(chǎn)品中,8個是國家集采中標(biāo)品種,包括硫酸氫氯吡格雷片、阿莫西林膠囊、阿奇霉素片、注射用紫杉醇(白蛋白結(jié)合型)、鹽酸二甲雙胍片/緩釋片、孟魯司特鈉咀嚼片、替格瑞洛片及鹽酸普拉克索片,其中6個產(chǎn)品是在近幾年獲批上市。
石藥集團(tuán)成藥業(yè)務(wù)各治療領(lǐng)域產(chǎn)品銷售情況
拿下重磅首仿,43個過評品種霸屏
公告顯示,2020年至今石藥集團(tuán)共有17個產(chǎn)品獲得藥品注冊批件,14個產(chǎn)品獲得臨床試驗批件,24個品種通過仿制藥一致性評價。
就在近日,石藥集團(tuán)的注射用頭孢曲松鈉通過一致性評價,以仿制4類報產(chǎn)的乙磺酸尼達(dá)尼布軟膠囊、恩替卡韋片獲批并視同過評。恩替卡韋是治療乙肝的一線藥物,尼達(dá)尼布是一種小分子酪氨酸激酶抑制劑,是全球首個獲批用于治療特發(fā)性肺纖維化(IPF)的靶向藥。
2021年至今,石藥集團(tuán)在國內(nèi)已有3個品種獲批上市,包括艾司奧美拉唑鎂腸溶膠囊、恩替卡韋片及乙磺酸尼達(dá)尼布軟膠囊。其中,乙磺酸尼達(dá)尼布軟膠囊為國內(nèi)首仿,艾司奧美拉唑鎂腸溶膠囊為國產(chǎn)第3家。
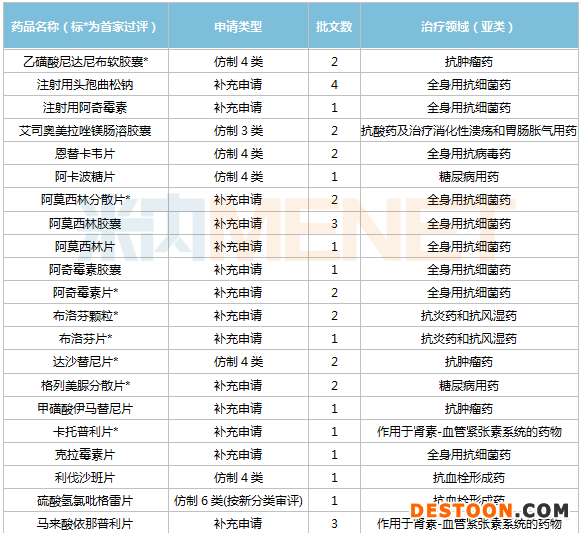
截至目前,石藥集團(tuán)已有43個品種(68個品規(guī))通過/視同通過一致性評價。43個品種中有15個全身用抗細(xì)菌藥、6個抗腫瘤藥,抗血栓形成藥及糖尿病用藥各有4個。
石藥集團(tuán)通過/視同通過一致性評價品種

來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫
從過評順序看,石藥集團(tuán)有16個品種為國內(nèi)首家過評,格列美脲分散片、鹽酸雷尼替丁膠囊、頭孢羥氨芐片、鹽酸曲馬多片、乙磺酸尼達(dá)尼布軟膠囊、阿莫西林分散片、達(dá)沙替尼片等7個品種暫時為獨家過評。
在國家開展的四批藥品帶量采購中,石藥集團(tuán)累計有18個品種中標(biāo)。其中12個品種是以新注冊分類獲批上市,市場正待開拓,中標(biāo)集采有助于快速放量。
四批集采石藥集團(tuán)中選情況
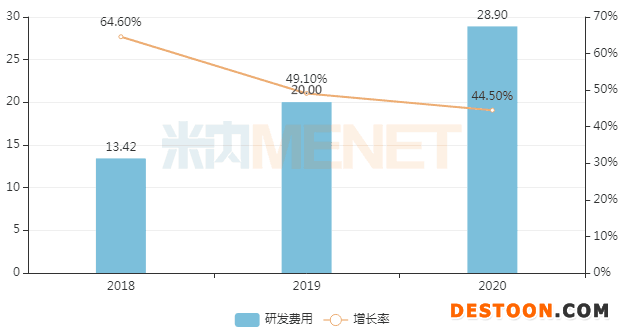
研發(fā)豪擲28.9億元!49個創(chuàng)新藥亮相
近日,石藥集團(tuán)的SKLB1028膠囊和SYHX1901片兩款1類新藥相繼獲批臨床,并重金引進(jìn)倍而達(dá)藥業(yè)的BPI-7711膠囊(EGFR -TKI)和康諾亞生物的CM310(IL-4Rα單抗)。研發(fā)管線的推進(jìn)與豐富,得益于公司大手筆的研發(fā)支出。近三年,石藥集團(tuán)在研發(fā)方面持續(xù)加大投入,研發(fā)費用復(fù)合增長率達(dá)到46.7%。2020年全年石藥集團(tuán)的研發(fā)費用大幅增加至28.9億元,同比增長44.5%。
2018-2020年石藥集團(tuán)研發(fā)費用情況(單位:億元)
石藥集團(tuán)專注于小分子靶向藥、納米藥物、單抗藥物、雙抗藥物、抗體偶聯(lián)藥物以及免疫領(lǐng)域生物藥物的發(fā)現(xiàn)、研究及開發(fā)。目前在研項目約300項,其中小分子創(chuàng)新藥40余項、大分子創(chuàng)新藥40余項,新型制劑20余項,主要聚焦在腫瘤、自身免疫、精神神經(jīng)、消化和代謝、心腦血管系統(tǒng)及抗感染等六大治療領(lǐng)域。
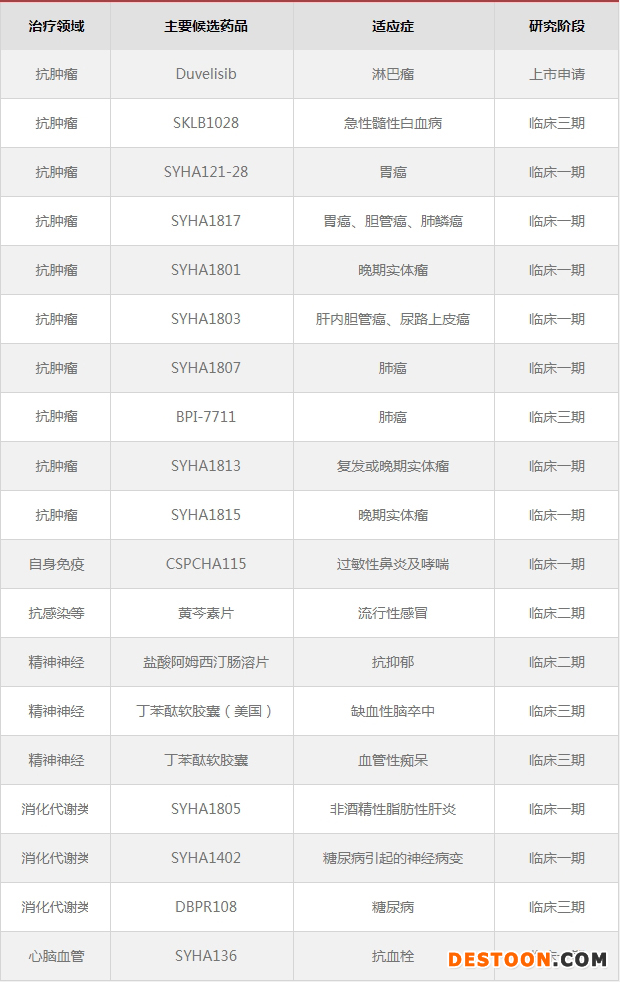
40余項在研小分子創(chuàng)新藥中,18項處于臨床研究階段,其中4項處于III期/注冊臨床階段,20余項處于臨床前研究階段。Duvelisib已提交上市申請,SKLB1028、BPI-7711、丁苯酞軟膠囊、DBPR108等均處于III期臨床研究階段。
石藥集團(tuán)主要在研小分子創(chuàng)新藥
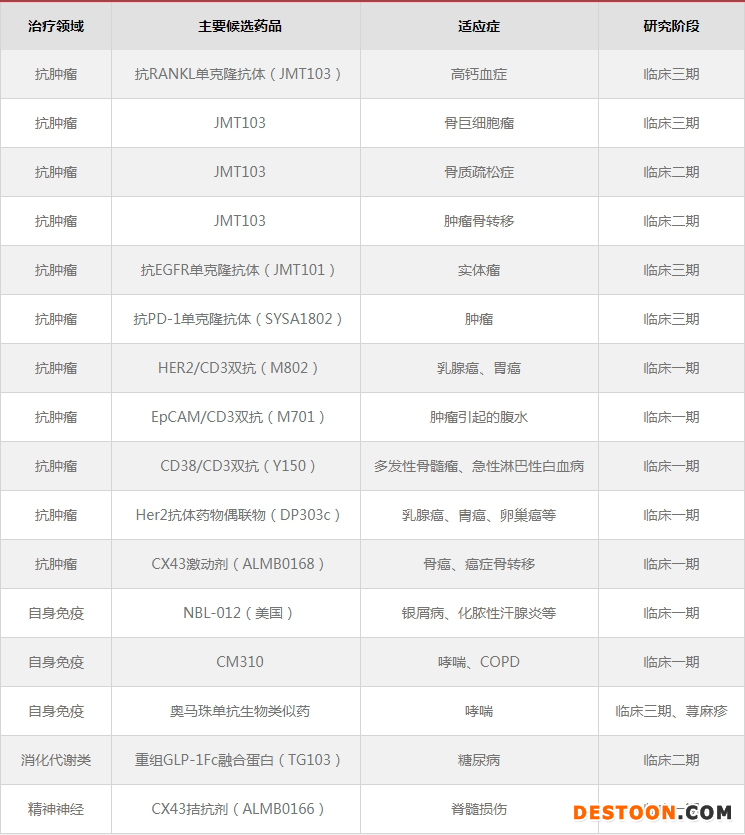
40余項在研大分子創(chuàng)新藥中,16項處于臨床研究階段,其中5項注冊臨床,20余項處于臨床前研究階段??筊ANKL單克隆抗體(JMT103)、抗EGFR單克隆抗體(JMT101)、抗PD-1單克隆抗體(SYSA1802)、奧馬珠單抗生物類似藥等均處于III期臨床研究階段,JMT103預(yù)計將于2022-2023年上市。
石藥集團(tuán)主要在研大分子創(chuàng)新藥
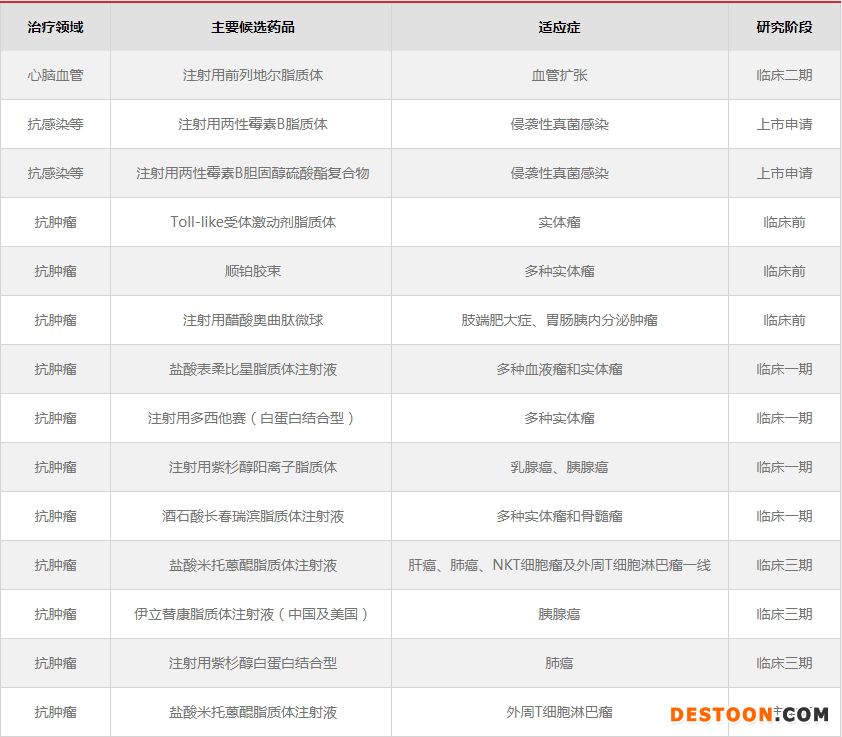
20余項在研新型制劑中,3項待批準(zhǔn)生產(chǎn),10項正在進(jìn)行臨床研究,10余項處于臨床前研究階段。其中,兩性霉素B脂質(zhì)體已提交上市申請,伊立替康脂質(zhì)體將于近期提交上市申請。兩性霉素B納米復(fù)合物、米托蒽醌脂質(zhì)體已報NDA并獲得優(yōu)先審評,預(yù)計今年獲批上市。
石藥集團(tuán)主要在研新型制劑
石藥集團(tuán)表示,將堅持創(chuàng)新的研發(fā)策略,持續(xù)加大研發(fā)投入,研發(fā)費用占銷售收入的比例保持在10%以上,每年都有新產(chǎn)品、大產(chǎn)品獲批上市。未來三年,石藥集團(tuán)預(yù)計將上市新產(chǎn)品60余個,其中預(yù)計市場空間超過10億元的重磅品種將不少于15個。
數(shù)據(jù)來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、公司公告等
注:數(shù)據(jù)統(tǒng)計截至3月17日,如有疏漏,歡迎指正!



