3月30日訊 近期,海思科可謂捷報(bào)頻傳,3月29日,連續(xù)發(fā)布兩個(gè)產(chǎn)品公告。海思科醫(yī)藥集團(tuán)股份有限公司全資子公司四川海思科制藥有限公司旗下全資子公司海思科制藥(眉山)有限公司收到國家藥監(jiān)局下發(fā)的《藥品注冊證書》,以仿制3類報(bào)產(chǎn)的阿伐那非片首仿獲批,并視同過評(píng)。此外,海思科醫(yī)藥集團(tuán)股份有限公司創(chuàng)新藥HSK21542注射液用于腹部腔鏡手術(shù)術(shù)后鎮(zhèn)痛的Ⅲ期臨床試驗(yàn)方案于近日獲CDE同意,可開始實(shí)施Ⅲ期臨床試驗(yàn)的受試者入組用藥等工作。
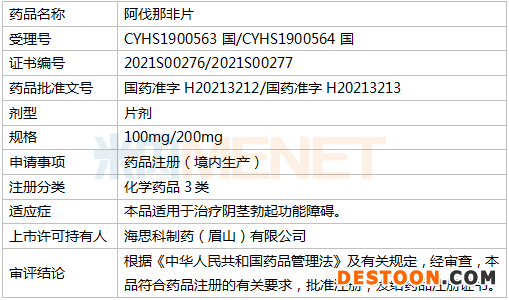
藥品相關(guān)情況
資料顯示,阿伐那非片最初由日本田邊三菱制藥株式會(huì)社授權(quán)美國VIVUS公司開發(fā)的用于治療男性勃起功能障礙的藥物,2012年4月在美國上市,商品名為Stendra。2013年6月被批準(zhǔn)在歐盟上市,商品名為Spedra。目前已在美國、德國、法國、意大利等多國上市,在國內(nèi)尚無生產(chǎn)和進(jìn)口,海思科開發(fā)的阿伐那非片是國內(nèi)首家仿制。
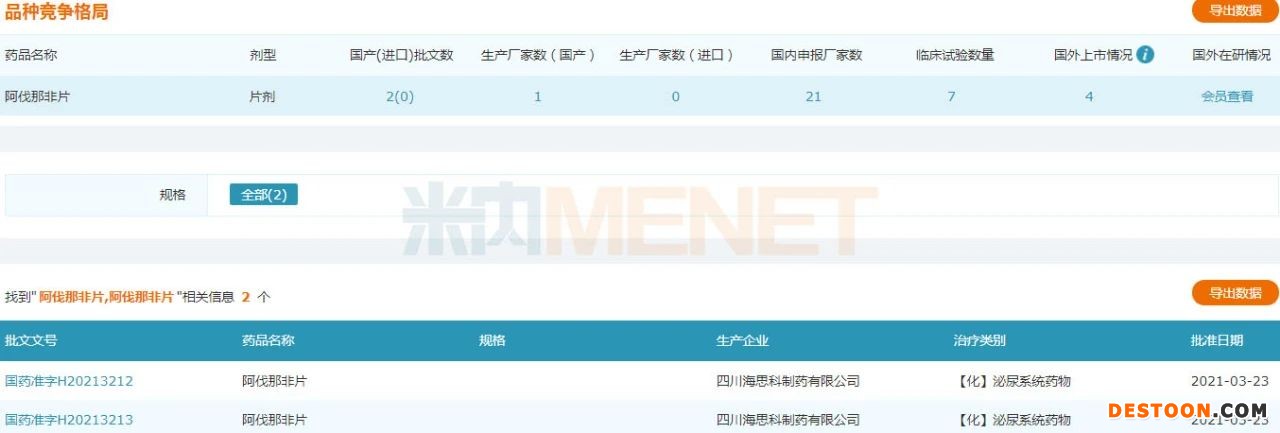
來源:米內(nèi)網(wǎng)一鍵檢索
阿伐那非片為海思科開發(fā)的仿制藥產(chǎn)品,該產(chǎn)品在2016年8月獲國家藥監(jiān)局頒發(fā)《藥物臨床試驗(yàn)批件》,在完成BE研究和Ⅲ期臨床研究后,2019年7月遞交了上市申請。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2019年中國城市公立醫(yī)院、縣級(jí)公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機(jī)構(gòu))及中國城市實(shí)體藥店終端抗ED藥物市場規(guī)模超過33億元。
同日,海思科還發(fā)布公告稱,海思科醫(yī)藥集團(tuán)股份有限公司創(chuàng)新藥HSK21542注射液用于腹部腔鏡手術(shù)術(shù)后鎮(zhèn)痛的Ⅲ期臨床試驗(yàn)方案于近日獲CDE同意,可開始實(shí)施Ⅲ期臨床試驗(yàn)的受試者入組用藥等工作。

藥品基本情況
HSK21542是由海思科自主研發(fā),具有完全自主知識(shí)產(chǎn)權(quán)的新分子實(shí)體化合物,屬于強(qiáng)效外周Kappa受體激動(dòng)劑,擬用于鎮(zhèn)痛、慢性腎臟疾病相關(guān)性瘙癢(CKD-aP)的治療等。截至公告披露日,全球尚未有獲批上市的同類化合物,目前同類化合物研發(fā)進(jìn)度最領(lǐng)先的為Cara Therapeutics Inc.(NASDAQ:CARA)開發(fā)的KORSUVA(CR845/difelikefalin)。
HSK21542于2019年10月-2020年10月在澳洲開展了I期臨床試驗(yàn);2020年1月-2020年9月在中國開展了I期臨床試驗(yàn);2020年6月-2021年2月在中國開展了用于腹部腔鏡手術(shù)術(shù)后鎮(zhèn)痛的Ⅱ期臨床試驗(yàn)。根據(jù)前期臨床試驗(yàn)數(shù)據(jù)結(jié)果,公司做出該項(xiàng)目進(jìn)入Ⅲ期臨床試驗(yàn)的決定。除上述適應(yīng)癥和臨床試驗(yàn)外,HSK21542目前還在開展在血液透析受試者中的Ⅱ期臨床試驗(yàn)。
米內(nèi)網(wǎng) 白羽 整理
來源:上市公司公告、米內(nèi)網(wǎng)數(shù)據(jù)庫



