3月20日,國家藥監(jiān)局發(fā)布公告稱,為全面反映2021年我國藥品不良反應(yīng)監(jiān)測情況,提高安全用藥水平,更好地保障公眾用藥安全,國家藥品不良反應(yīng)監(jiān)測中心組織編撰《國家藥品不良反應(yīng)監(jiān)測年度報(bào)告(2021年)》。
第1章 藥品不良反應(yīng)監(jiān)測工作情況
2021年,國家藥品不良反應(yīng)監(jiān)測中心在國家藥品監(jiān)督管理局的領(lǐng)導(dǎo)下,深入貫徹落實(shí)黨中央、國務(wù)院決策部署,以習(xí)近平總書記“四個(gè)最嚴(yán)”要求為根本遵循,扎實(shí)開展藥品不良反應(yīng)監(jiān)測評價(jià)工作,監(jiān)測評價(jià)體系逐步健全,法規(guī)制度日趨完善,報(bào)告數(shù)量和質(zhì)量穩(wěn)步提升,監(jiān)測評價(jià)手段和方法更加成熟,各項(xiàng)工作取得明顯成效,為藥品監(jiān)管提供科學(xué)有力支撐,切實(shí)保護(hù)和促進(jìn)公眾健康。
一是強(qiáng)化布局謀篇,推動(dòng)體系和能力建設(shè)。推進(jìn)落實(shí)國務(wù)院辦公廳《關(guān)于全面加強(qiáng)藥品監(jiān)管能力建設(shè)的實(shí)施意見》《國家藥監(jiān)局關(guān)于進(jìn)一步加強(qiáng)藥品不良反應(yīng)監(jiān)測評價(jià)體系和能力建設(shè)的意見》,加快構(gòu)建“一體兩翼”工作格局,不斷完善監(jiān)測評價(jià)制度體系,持續(xù)提高監(jiān)測評價(jià)能力。
二是完善法規(guī)體系,出臺(tái)配套技術(shù)規(guī)范。發(fā)布我國首部《藥物警戒質(zhì)量管理規(guī)范》,完成《藥物警戒檢查指導(dǎo)原則》《藥物警戒體系主文件撰寫指南》起草和征求意見,指導(dǎo)藥品上市許可持有人(以下簡稱持有人)開展監(jiān)測、報(bào)告、分析和評價(jià)工作,推動(dòng)藥物警戒制度建立健全。
三是科學(xué)分析評價(jià),發(fā)揮技術(shù)支撐作用。密切關(guān)注國內(nèi)外監(jiān)管動(dòng)態(tài),強(qiáng)化監(jiān)測數(shù)據(jù)分析評價(jià)。根據(jù)評價(jià)結(jié)果,及時(shí)發(fā)布藥品安全警示信息。2021年發(fā)布注銷小兒酚氨咖敏顆粒等品種藥品注冊證書公告2期,發(fā)布藥品說明書修訂公告48期。
四是有效監(jiān)測風(fēng)險(xiǎn),保障疫情防控大局。嚴(yán)格落實(shí)常態(tài)化疫情防控措施,持續(xù)加強(qiáng)新冠肺炎防控及治療藥品監(jiān)測、分析和評價(jià),密切跟進(jìn)《新型冠狀病毒肺炎診療方案》所列藥品,重點(diǎn)關(guān)注相關(guān)預(yù)警信號、群體事件及藥品不良反應(yīng)報(bào)告情況,切實(shí)保障疫情防控用藥安全。
五是優(yōu)化信息系統(tǒng),助力監(jiān)測評價(jià)發(fā)展。完成E2B(R3)電子數(shù)據(jù)管理系統(tǒng)建設(shè),實(shí)現(xiàn)在線報(bào)告、可擴(kuò)展標(biāo)記語言格式文件遞交多種途徑報(bào)告功能。完善國家藥品不良反應(yīng)監(jiān)測信息化體系,提高數(shù)據(jù)分析效率,提升監(jiān)測評價(jià)效能。
第2章 藥品不良反應(yīng)/事件報(bào)告情況
2.1 報(bào)告總體情況
2.1.1 2021年度藥品不良反應(yīng)/事件報(bào)告情況
2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)收到《藥品不良反應(yīng)/事件報(bào)告表》196.2萬份。1999年至2021年,全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)累計(jì)收到《藥品不良反應(yīng)/事件報(bào)告表》1,883萬份(圖1)。
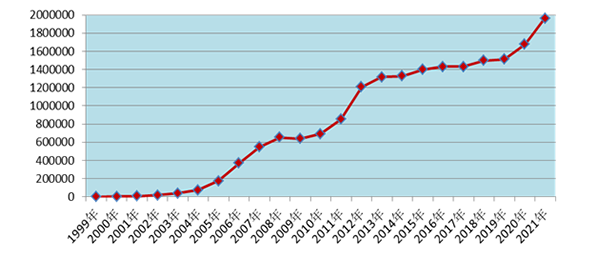
圖1 1999年-2021年全國藥品不良反應(yīng)/事件報(bào)告數(shù)量增長趨勢
2.1.2 新的和嚴(yán)重藥品不良反應(yīng)/事件報(bào)告情況
2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)收到新的和嚴(yán)重藥品不良反應(yīng)/事件報(bào)告59.7萬份;新的和嚴(yán)重藥品不良反應(yīng)/事件報(bào)告占同期報(bào)告總數(shù)的30.4%。
2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)收到嚴(yán)重藥品不良反應(yīng)/事件報(bào)告21.6萬份,嚴(yán)重藥品不良反應(yīng)/事件報(bào)告占同期報(bào)告總數(shù)的11.0%(圖2)。
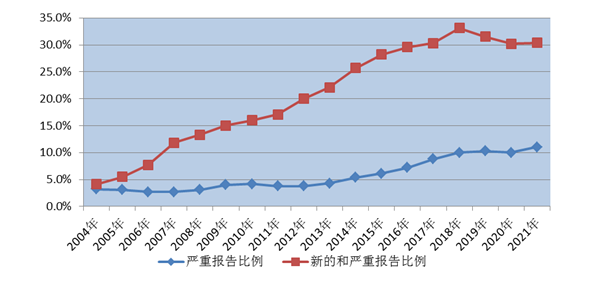
圖2 2004年-2021年新的和嚴(yán)重以及嚴(yán)重藥品不良反應(yīng)/事件報(bào)告比例
小貼士:
如何正確認(rèn)識(shí)藥品不良反應(yīng)報(bào)告?
藥品不良反應(yīng)是指合格藥品在正常用法用量下出現(xiàn)的與用藥目的無關(guān)的有害反應(yīng)。藥品不良反應(yīng)是藥品的固有屬性,一般來說,所有藥品都會(huì)存在或多或少、或輕或重的不良反應(yīng)。
藥品不良反應(yīng)監(jiān)測是藥品上市后安全監(jiān)管的重要支撐,其目的是及時(shí)發(fā)現(xiàn)和控制藥品安全風(fēng)險(xiǎn)。持有人、經(jīng)營企業(yè)、醫(yī)療機(jī)構(gòu)應(yīng)當(dāng)報(bào)告所發(fā)現(xiàn)的藥品不良反應(yīng),國家鼓勵(lì)公民、法人和其他組織報(bào)告藥品不良反應(yīng)。
經(jīng)過各方努力,持有人、經(jīng)營企業(yè)、醫(yī)療機(jī)構(gòu)報(bào)告藥品不良反應(yīng)的積極性已經(jīng)逐步提高,我國藥品不良反應(yīng)報(bào)告數(shù)量總體呈上升趨勢。嚴(yán)重藥品不良反應(yīng)/事件報(bào)告比例是衡量報(bào)告總體質(zhì)量和可利用性的重要指標(biāo)之一,藥品不良反應(yīng)監(jiān)測評價(jià)工作一直將收集和評價(jià)新的和嚴(yán)重反應(yīng)作為重點(diǎn)內(nèi)容。新的和嚴(yán)重藥品不良反應(yīng)報(bào)告,尤其是嚴(yán)重藥品不良反應(yīng)報(bào)告數(shù)量多了,并非說明藥品安全水平下降,而是意味著監(jiān)管部門掌握的信息越來越全面,對藥品的風(fēng)險(xiǎn)更了解,風(fēng)險(xiǎn)更可控,對藥品的評價(jià)更加有依據(jù),監(jiān)管決策更加準(zhǔn)確。同樣,在醫(yī)療實(shí)踐中,能及時(shí)了解藥品不良反應(yīng)發(fā)生的表現(xiàn)、程度,并最大限度地加以避免,也是保證患者用藥安全的重要措施。
2.1.3 每百萬人口平均報(bào)告情況
每百萬人口平均報(bào)告數(shù)量是衡量一個(gè)國家藥品不良反應(yīng)監(jiān)測工作水平的重要指標(biāo)之一。2021年我國每百萬人口平均報(bào)告數(shù)為1,392份。
2.1.4 藥品不良反應(yīng)/事件縣級報(bào)告比例
藥品不良反應(yīng)/事件縣級報(bào)告比例是衡量我國藥品不良反應(yīng)監(jiān)測工作均衡發(fā)展及覆蓋程度的重要指標(biāo)之一。2021年全國98.0%的縣級地區(qū)報(bào)告了藥品不良反應(yīng)/事件。
2.1.5 藥品不良反應(yīng)/事件報(bào)告來源
持有人、經(jīng)營企業(yè)和醫(yī)療機(jī)構(gòu)是藥品不良反應(yīng)報(bào)告的責(zé)任單位。按照報(bào)告來源統(tǒng)計(jì),2021年來自醫(yī)療機(jī)構(gòu)的報(bào)告占86.3%;來自經(jīng)營企業(yè)的報(bào)告占9.4%;來自持有人的報(bào)告占4.1%;來自個(gè)人及其他報(bào)告者的報(bào)告占0.2%(圖3)。

圖3 2021年藥品不良反應(yīng)/事件報(bào)告來源
按照報(bào)告數(shù)量統(tǒng)計(jì),2021年持有人報(bào)送藥品不良反應(yīng)/事件報(bào)告共計(jì)8.1萬份,同比增長22.3%。其中,新的和嚴(yán)重藥品不良反應(yīng)/事件報(bào)告占持有人報(bào)告總數(shù)的34.7%,高于總體報(bào)告中新的和嚴(yán)重藥品不良反應(yīng)/事件報(bào)告占比。
2.1.6 報(bào)告人職業(yè)
按照報(bào)告人職業(yè)統(tǒng)計(jì),醫(yī)生占55.6%,藥師占25.5%,護(hù)士占13.0%,其他職業(yè)占5.9%(圖4)。
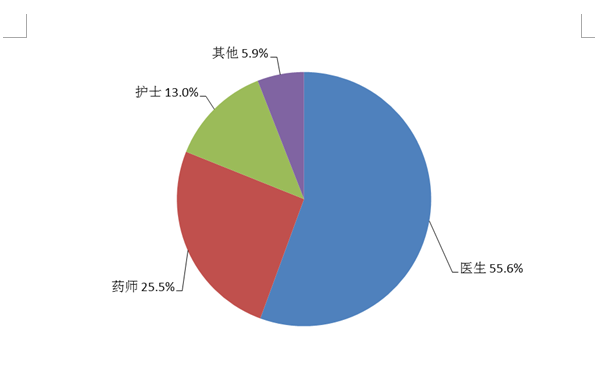
圖4 2021年報(bào)告人職業(yè)構(gòu)成
2.1.7 藥品不良反應(yīng)/事件報(bào)告涉及患者情況
2021年藥品不良反應(yīng)/事件報(bào)告中,女性多于男性,男女性別比為0.86:1。從年齡分布看,14歲以下兒童占8.4%,65歲及以上老年患者占31.2%(圖5)。
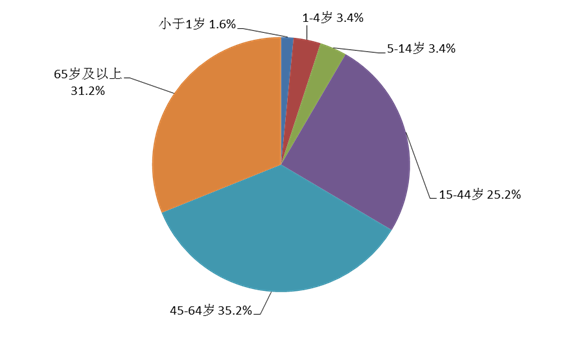
圖5 2021年藥品不良反應(yīng)/事件報(bào)告涉及患者年齡
2.1.8 藥品不良反應(yīng)/事件報(bào)告涉及藥品情況
按照懷疑藥品類別統(tǒng)計(jì),化學(xué)藥品占82.0%、中藥占13.0%、生物制品占2.0%、無法分類者占3.0%(圖6)。
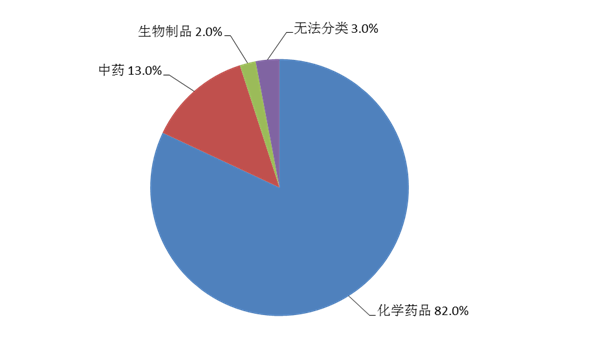
圖6 2021年藥品不良反應(yīng)/事件報(bào)告涉及藥品類別
按照給藥途徑統(tǒng)計(jì),2021年藥品不良反應(yīng)/事件報(bào)告中,注射給藥占55.3%、口服給藥占37.9%、其他給藥途徑占6.8%。注射給藥中,靜脈注射給藥占90.5%、其他注射給藥占9.5%(圖7)。
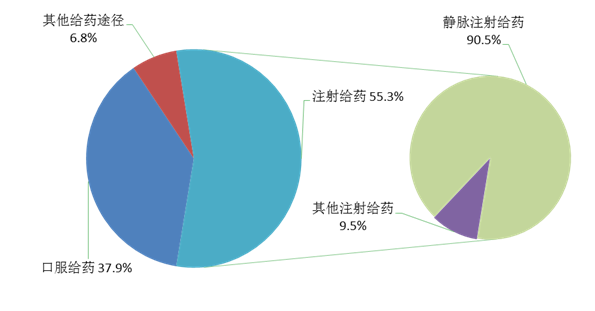
圖7 2021年藥品不良反應(yīng)/事件報(bào)告涉及給藥途徑
2.1.9 藥品不良反應(yīng)/事件累及器官系統(tǒng)情況
2021年報(bào)告的藥品不良反應(yīng)/事件中,累及器官系統(tǒng)排名前3位依次為胃腸系統(tǒng)疾病、皮膚及皮下組織類疾病、全身性疾病及給藥部位各種反應(yīng)。

圖8 2021年藥品不良反應(yīng)/事件累及器官系統(tǒng)
2.2 化學(xué)藥品、生物制品監(jiān)測情況
2.2.1 總體情況
2021年藥品不良反應(yīng)/事件報(bào)告中,涉及懷疑藥品210.4萬例次,其中化學(xué)藥品占82.0%,生物制品占2.0%。2021年嚴(yán)重不良反應(yīng)/事件報(bào)告涉及懷疑藥品27.8萬例次,其中化學(xué)藥品占87.7%,生物制品占4.3%。
2.2.2 涉及患者情況
2021年化學(xué)藥品、生物制品不良反應(yīng)/事件報(bào)告中,男女患者比為0.87:1,女性多于男性。14歲以下兒童患者的報(bào)告占8.6%,65歲及以上老年患者的報(bào)告占31.4%。
2.2.3 涉及藥品情況
2021年藥品不良反應(yīng)/事件報(bào)告涉及的化學(xué)藥品中,例次數(shù)排名前5位的類別依次為抗感染藥、腫瘤用藥、心血管系統(tǒng)用藥、鎮(zhèn)痛藥、消化系統(tǒng)用藥。2021年嚴(yán)重藥品不良反應(yīng)/事件涉及化學(xué)藥品中,報(bào)告數(shù)量最多的為腫瘤用藥,占33.2%;其次是抗感染藥,占28.1%。按嚴(yán)重報(bào)告占本類別報(bào)告比例計(jì)算,腫瘤用藥的嚴(yán)重報(bào)告比例最高,為43.0%,其次是運(yùn)動(dòng)系統(tǒng)用藥,為19.9%。
2021年藥品不良反應(yīng)/事件報(bào)告涉及的生物制品中,細(xì)胞因子占71.7%、抗毒素及免疫血清占16.0%、血液制品占0.8%、診斷用生物制品占0.2%。
按劑型統(tǒng)計(jì),2021年化學(xué)藥品不良反應(yīng)/事件報(bào)告中,注射劑、口服制劑所占比例分別為59.5%和34.8%,其他劑型占5.7%。生物制品中,注射劑、口服制劑占比分別為83.5%和0.2%,其他制劑占16.3%。
2.2.4 總體情況分析
2021年化學(xué)藥品和生物制品不良反應(yīng)/事件報(bào)告情況與2020年相比未出現(xiàn)顯著變化。從不良反應(yīng)涉及患者年齡看,14歲以下兒童占比依然延續(xù)了去年的下降趨勢,但降幅有所減緩,兒童用藥的安全性總體依然良好;65歲及以上老年患者占比持續(xù)升高,提示臨床應(yīng)重點(diǎn)關(guān)注老年患者的用藥安全。從藥品劑型上看,注射劑占比仍呈下降趨勢,風(fēng)險(xiǎn)進(jìn)一步降低。從藥品類別上看,抗感染藥報(bào)告數(shù)量居于首位,其占比已連續(xù)十年呈下降趨勢,抗感染藥的合理使用顯現(xiàn)出明顯效果;腫瘤用藥占比繼續(xù)上升,其嚴(yán)重報(bào)告構(gòu)成比居首位,提示臨床需繼續(xù)加強(qiáng)該類藥品的風(fēng)險(xiǎn)管理。生物制品報(bào)告占比有所升高,其中細(xì)胞因子的占比升幅相對突出,主要與近年來PD-1/PD-L1類新型腫瘤用藥上市品種快速增加并且一些品種列入醫(yī)保目錄有關(guān)。
小貼士:
PD-1/PD-L1類新型腫瘤用藥的不良反應(yīng)
PD-1/PD-L1免疫療法是目前除了常規(guī)手術(shù)治療、放化療和靶向治療之外的新抗癌療法。程序性細(xì)胞死亡受體-1(PD-1)及其配體(PD-L1)抑制劑是近兩年開發(fā)的新型抗腫瘤藥,其作用是阻斷腫瘤細(xì)胞和人體T細(xì)胞的結(jié)合,使T細(xì)胞能正常發(fā)揮免疫功能,識(shí)別出腫瘤細(xì)胞并進(jìn)行清除。
2018年我國批準(zhǔn)了第一個(gè)PD-1類抗腫瘤藥納武利尤單抗,此后三年又有十余個(gè)PD-1/PD-L1產(chǎn)品上市,如特瑞普利單抗、信迪利單抗、卡瑞利珠單抗、阿替利珠單抗等,部分品種還進(jìn)入了醫(yī)保目錄。PD-1/PD-L1類藥品臨床用量增加的同時(shí),其安全性也引起人們的關(guān)注。根據(jù)權(quán)威雜志發(fā)表的臨床研究薈萃分析結(jié)果,PD-1/PD-L1類藥物的常見和偶見不良反應(yīng)包括乏力、瘙癢、腹瀉、皮疹、惡心、食欲下降、貧血、呼吸困難等。臨床應(yīng)關(guān)注的免疫治療相關(guān)不良反應(yīng)包括肺炎、肝酶升高、甲狀腺功能減退/亢進(jìn)、腎上腺功能不全、垂體炎等,有些可能危及生命,需要積極就診。
腫瘤用藥的不良反應(yīng)發(fā)生率、嚴(yán)重不良反應(yīng)發(fā)生風(fēng)險(xiǎn)均高于其他類別的藥品,但可以拯救或延長患者的生命?;颊邞?yīng)了解抗腫瘤藥品的不良反應(yīng)及處置措施,配合醫(yī)生積極治療、合理用藥,從而獲取最大的健康利益。
2.3 中藥監(jiān)測情況
2.3.1 總體情況
2021年藥品不良反應(yīng)/事件報(bào)告中,涉及懷疑藥品210.4萬例次,其中中藥占13.0%;2021年嚴(yán)重不良反應(yīng)/事件報(bào)告涉及懷疑藥品27.8萬例次,其中中藥占5.1%。
2.3.2 涉及患者情況
2021年中藥不良反應(yīng)/事件報(bào)告中,男女患者比為0.81:1。14歲以下兒童患者占5.7%,65歲及以上老年患者占29.3%。
2.3.3 涉及藥品情況
2021年藥品不良反應(yīng)/事件報(bào)告涉及的中藥中,例次數(shù)排名前5位的類別分別是理血?jiǎng)┲谢钛鏊帲?4.5%)、清熱劑中清熱解毒藥(11.7%)、祛濕劑中清熱除濕藥(7.1%)、祛濕劑中祛風(fēng)勝濕藥(5.2%)、補(bǔ)益劑中益氣養(yǎng)陰藥(4.9%)。2021年中藥嚴(yán)重不良反應(yīng)/事件報(bào)告的例次數(shù)排名前5位的類別分別是理血?jiǎng)┲谢钛鏊帲?9.0%)、補(bǔ)益劑中益氣養(yǎng)陰藥(10.7%)、清熱劑中清熱解毒藥(8.6%)、開竅劑中涼開藥(6.4%)、補(bǔ)益劑中補(bǔ)陽藥(4.2%)。
2021年中藥不良反應(yīng)/事件報(bào)告按照給藥途徑統(tǒng)計(jì),注射給藥占27.5%、口服給藥占60.5%、其他給藥途徑占12.0%。注射給藥中,靜脈注射給藥占97.2%、其他注射給藥占2.8%。
2.3.4 總體情況分析
與2020年相比,2021年中藥不良反應(yīng)/事件報(bào)告數(shù)量有所上升,但嚴(yán)重報(bào)告占比有所下降。從給藥途徑看,注射給藥占比下降較為明顯。從藥品類別上看,活血化瘀藥的報(bào)告數(shù)量依然居首位,但占比略有下降。從總體情況看,2021年中藥占總體不良反應(yīng)/事件報(bào)告比例呈下降趨勢,但仍需要注意安全用藥。
小貼士:
為什么中藥會(huì)引起不良反應(yīng)?
“是藥三分毒”,中藥和其他藥品一樣,在發(fā)揮治療作用的同時(shí),也可能會(huì)產(chǎn)生一定不良反應(yīng)。辨證論治是中醫(yī)認(rèn)識(shí)疾病和治療疾病的基本原則,嚴(yán)格按照說明書規(guī)定的功能主治使用中藥,有助于減少和避免不良反應(yīng)/事件的發(fā)生。但是如果不遵循中醫(yī)辨證論治的原則或者辨證不當(dāng)、超說明書功能主治用藥,可能使中藥不良反應(yīng)/事件發(fā)生的風(fēng)險(xiǎn)增加。隨著認(rèn)識(shí)水平的提高,中藥的臨床使用亦日趨廣泛,中藥的不良反應(yīng)也應(yīng)引起重視。
2.4 基本藥物監(jiān)測情況
2.4.1 國家基本藥物監(jiān)測總體情況
2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)共收到《國家基本藥物目錄(2018年版)》收載品種的不良反應(yīng)/事件報(bào)告94.6萬份,其中嚴(yán)重報(bào)告11.3萬份,占11.9%。報(bào)告涉及化學(xué)藥品和生物制品占88.6%,中成藥占11.4%。
2.4.2 國家基本藥物化學(xué)藥品和生物制品情況分析
《國家基本藥物目錄(2018年版)》化學(xué)藥品和生物制品部分共417個(gè)(類)品種。2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)共收到國家基本藥物化學(xué)藥品和生物制品藥品不良反應(yīng)/事件報(bào)告89.7萬例次,其中嚴(yán)重報(bào)告13.5萬例次,占15.0%。
2021年國家基本藥物化學(xué)藥品和生物制品不良反應(yīng)/事件報(bào)告按照藥品類別統(tǒng)計(jì),報(bào)告數(shù)量排名前5位的分別是抗微生物藥、心血管系統(tǒng)用藥、抗腫瘤藥、激素及影響內(nèi)分泌藥、治療精神障礙藥;累及器官系統(tǒng)排名前5位的是胃腸系統(tǒng)疾病、皮膚及皮下組織類疾病、各類神經(jīng)系統(tǒng)疾病、全身性疾病及給藥部位各種反應(yīng)、各類檢查。
2.4.3 國家基本藥物中成藥情況分析
《國家基本藥物目錄(2018年版)》中成藥共涉及268個(gè)品種。2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)收到國家基本藥物中成藥不良反應(yīng)/事件報(bào)告11.5萬例次,其中嚴(yán)重報(bào)告5,950例次,占5.2%。2021年國家基本藥物7大類中成藥中,藥品不良反應(yīng)/事件報(bào)告總數(shù)由多到少依次為內(nèi)科用藥、骨傷科用藥、婦科用藥、外科用藥、耳鼻喉科用藥、兒科用藥、眼科用藥。
以上監(jiān)測數(shù)據(jù)表明,2021年國家基本藥物監(jiān)測總體情況基本保持平穩(wěn)。
小貼士:
《國家基本藥物目錄(2018年版)》收錄品種情況
2018年11月1日起,我國正式啟用《國家基本藥物目錄(2018年版)》。該目錄主要分為化學(xué)藥品和生物制品、中成藥和中藥飲片三個(gè)部分。其中化學(xué)藥品和生物制品部分包括抗微生物藥、抗寄生蟲病藥、麻醉藥等26類藥品,中成藥部分包括內(nèi)科用藥、外科用藥、婦科用藥等7類藥品。與2012年版基藥目錄相比,2018年版基藥目錄共調(diào)入藥品187種,調(diào)出22種(其中17個(gè)為化藥),目錄總品種數(shù)量由原來的520種增加到685種,其中西藥417種、中成藥268種。
第3章 相關(guān)風(fēng)險(xiǎn)控制措施
根據(jù)2021年藥品不良反應(yīng)監(jiān)測數(shù)據(jù)和分析評價(jià)結(jié)果,國家藥品監(jiān)督管理局對發(fā)現(xiàn)存在安全隱患的藥品及時(shí)采取相應(yīng)風(fēng)險(xiǎn)控制措施,以保障公眾用藥安全。
發(fā)布注銷小兒酚氨咖敏顆粒、氨非咖片等10個(gè)品種藥品注冊證書的公告2期。
發(fā)布大活絡(luò)制劑、柳氮磺吡啶制劑、甲巰咪唑制劑等藥品說明書修訂公告共48期,增加或完善74個(gè)(類)品種說明書中的警示語、不良反應(yīng)、注意事項(xiàng)、禁忌等安全性信息。
發(fā)布《藥物警戒快訊》12期,報(bào)道國外藥品安全信息52條。
第4章 各論
根據(jù)藥品不良反應(yīng)監(jiān)測結(jié)果以及公眾關(guān)注情況,對抗感染藥、心血管系統(tǒng)用藥、代謝及內(nèi)分泌系統(tǒng)用藥、注射劑的不良反應(yīng)報(bào)告情況進(jìn)行分析,并提示安全風(fēng)險(xiǎn)如下:
4.1 抗感染藥不良反應(yīng)監(jiān)測情況
抗感染藥是指具有殺滅或抑制各種病原微生物作用的藥品,包括抗生素、合成抗菌藥、抗真菌藥、抗病毒藥等,是臨床應(yīng)用最為廣泛的藥品類別之一,其不良反應(yīng)/事件報(bào)告數(shù)量一直居于首位,是藥品不良反應(yīng)監(jiān)測工作關(guān)注的重點(diǎn)。
2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)共收到抗感染藥不良反應(yīng)/事件報(bào)告55.1萬份,其中嚴(yán)重報(bào)告6.2萬份,占11.2%??垢腥舅幉涣挤磻?yīng)/事件報(bào)告數(shù)量占2021年總體報(bào)告數(shù)量的28.1%。
4.1.1 涉及藥品情況
2021年抗感染藥不良反應(yīng)/事件報(bào)告數(shù)量排名前3位的藥品類別分別是頭孢菌素類、喹諾酮類、大環(huán)內(nèi)酯類,嚴(yán)重不良反應(yīng)/事件報(bào)告數(shù)量排名前3位的藥品類別分別是頭孢菌素類、喹諾酮類、抗結(jié)核病藥。
2021年抗感染藥不良反應(yīng)/事件報(bào)告中,注射劑占76.3%,口服制劑占19.8%,其他劑型占3.9%;與藥品總體報(bào)告劑型分布相比,注射劑比例偏高。嚴(yán)重不良反應(yīng)/事件報(bào)告中,注射劑占78.6%,口服制劑占20.1%,其他劑型占1.3%。
4.1.2 累及器官系統(tǒng)情況
2021年抗感染藥不良反應(yīng)/事件報(bào)告中,總體報(bào)告和嚴(yán)重報(bào)告的藥品不良反應(yīng)/事件累及器官系統(tǒng)情況詳見圖9。與抗感染藥的總體報(bào)告相比,嚴(yán)重報(bào)告的全身性疾病及給藥部位各種反應(yīng),免疫系統(tǒng)疾病,呼吸系統(tǒng)、胸及縱隔疾病,各類檢查構(gòu)成比明顯偏高。
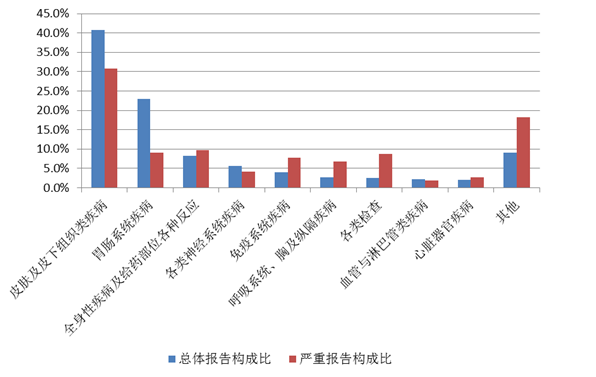
圖9 2021年抗感染藥不良反應(yīng)/事件累及器官系統(tǒng)
抗感染藥藥品不良反應(yīng)/事件總體報(bào)告中,口服制劑累及器官系統(tǒng)排名前5位的是胃腸系統(tǒng)疾病、皮膚及皮下組織類疾病、各類神經(jīng)系統(tǒng)疾病、肝膽系統(tǒng)疾病、全身性疾病及給藥部位各種反應(yīng);注射劑累及器官系統(tǒng)排名前5位是皮膚及皮下組織類疾病、胃腸系統(tǒng)疾病、全身性疾病及給藥部位各種反應(yīng)、各類神經(jīng)系統(tǒng)疾病、免疫系統(tǒng)疾病。
抗感染藥嚴(yán)重藥品不良反應(yīng)/事件報(bào)告中,口服制劑累及器官系統(tǒng)排名前5位是皮膚及皮下組織類疾病、肝膽系統(tǒng)疾病、各類檢查、代謝及營養(yǎng)類疾病、胃腸系統(tǒng)疾?。蛔⑸鋭├奂捌鞴傧到y(tǒng)排名前5位是皮膚及皮下組織類疾病、全身性疾病及給藥部位各種反應(yīng)、免疫系統(tǒng)疾病、胃腸系統(tǒng)疾病、各類檢查。
4.1.3 監(jiān)測情況分析及安全風(fēng)險(xiǎn)提示
近年來,抗感染藥不良反應(yīng)/事件報(bào)告占總體報(bào)告比例呈現(xiàn)持續(xù)下降趨勢,說明國家加強(qiáng)抗感染藥使用管理等措施取得一定實(shí)效,但其嚴(yán)重不良反應(yīng)報(bào)告數(shù)量仍然較高,提示抗感染藥的用藥風(fēng)險(xiǎn)仍需繼續(xù)關(guān)注。
小貼士:
注射用阿洛西林鈉臨床使用時(shí)應(yīng)注意些什么?
阿洛西林為半合成的廣譜青霉素,其抗菌作用機(jī)制與青霉素相似。同其他青霉素類藥物一樣,接受注射用阿洛西林鈉治療的患者有發(fā)生嚴(yán)重過敏反應(yīng)的風(fēng)險(xiǎn),包括過敏性休克,嚴(yán)重者可導(dǎo)致死亡。過敏反應(yīng)更容易發(fā)生在具有青霉素類藥物過敏史和/或?qū)Χ喾N過敏原有過敏史的患者中,有明顯過敏和/或哮喘病史的患者(有哮喘、濕疹、枯草熱、蕁麻疹等過敏性疾病史者)應(yīng)慎用。大劑量靜脈給予阿洛西林或有嚴(yán)重腎功能不全的患者,可能會(huì)引起神經(jīng)毒性反應(yīng),包括反射亢進(jìn)、肌陣攣性抽搐、驚厥和昏迷。另外,本品在臨床使用時(shí)應(yīng)現(xiàn)配現(xiàn)用,不宜放置,也不宜與其他藥品配伍使用,與其他藥品序貫使用時(shí)應(yīng)更換輸液器。
4.2 心血管系統(tǒng)用藥不良反應(yīng)監(jiān)測情況
心血管系統(tǒng)用藥是指用于心臟疾病治療、血管保護(hù)、血壓和血脂調(diào)節(jié)的藥品,包括降血壓藥、抗心絞痛藥、血管活性藥、抗動(dòng)脈粥樣硬化藥、抗心律失常藥、強(qiáng)心藥和其他心血管系統(tǒng)用藥。近年來,心血管系統(tǒng)用藥不良反應(yīng)/事件報(bào)告數(shù)量及嚴(yán)重報(bào)告占比均呈現(xiàn)上升趨勢,提示應(yīng)對該類藥品風(fēng)險(xiǎn)給予更多關(guān)注。
2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)共收到心血管系統(tǒng)用藥的不良反應(yīng)/事件報(bào)告18.6萬份,占總體報(bào)告的9.5%;其中嚴(yán)重報(bào)告11,129份,占6.0%。
4.2.1 涉及藥品情況
2021年心血管系統(tǒng)用藥不良反應(yīng)/事件報(bào)告數(shù)量排名前3位的藥品類別是降血壓藥、抗心絞痛藥、抗動(dòng)脈粥樣硬化藥;心血管系統(tǒng)用藥嚴(yán)重報(bào)告數(shù)量排名前3位的藥品類別是抗動(dòng)脈粥樣硬化藥、降血壓藥、抗心絞痛藥。
2021年心血管系統(tǒng)用藥不良反應(yīng)/事件報(bào)告中,注射劑占29.4%,口服制劑占69.3%,其他劑型占1.3%;嚴(yán)重報(bào)告中,注射劑占40.2%,口服制劑占58.5%,其他劑型占1.3%。
4.2.2 累及器官系統(tǒng)情況
2021年心血管系統(tǒng)用藥不良反應(yīng)/事件報(bào)告中,口服制劑累及器官系統(tǒng)排名前5位是各類神經(jīng)系統(tǒng)疾病,胃腸系統(tǒng)疾病,全身性疾病及給藥部位各種反應(yīng),呼吸系統(tǒng)、胸及縱隔疾病,皮膚及皮下組織類疾病;注射劑累及器官系統(tǒng)前5位是各類神經(jīng)系統(tǒng)疾病、胃腸系統(tǒng)疾病、皮膚及皮下組織類疾病、全身性疾病及給藥部位各種反應(yīng)、心臟器官疾?。▓D10)。
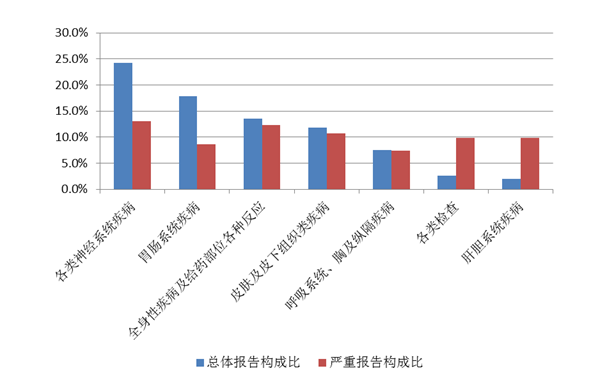
圖10 2021年心血管系統(tǒng)用藥不良反應(yīng)/事件累及器官系統(tǒng)
4.2.3 監(jiān)測情況分析及安全風(fēng)險(xiǎn)提示
2021年心血管系統(tǒng)用藥不良反應(yīng)/事件報(bào)告中,口服制劑的報(bào)告占比明顯高于注射劑,提示心血管系統(tǒng)用藥不良反應(yīng)/事件報(bào)告更多來自口服給藥途徑。嚴(yán)重不良反應(yīng)/事件報(bào)告中,報(bào)告數(shù)量位居前兩位的阿托伐他汀和瑞舒伐他汀均為他汀類藥品,血脂調(diào)節(jié)藥品不僅用于血脂代謝紊亂及相關(guān)心血管疾病的治療,還用于此類疾病的預(yù)防。此外,不排除其中存在不合理、不規(guī)范使用和藥品相互作用導(dǎo)致的情況,提示醫(yī)務(wù)人員和患者應(yīng)關(guān)注此類藥品的風(fēng)險(xiǎn)。
小貼士 :
患者使用他汀類藥品應(yīng)注意什么?
他汀類藥品為3-羥基-3甲基戊二酰輔酶A還原酶抑制藥,能降低總膽固醇和低密度脂蛋白,以及能一定程度上降低三酰甘油,升高高密度脂蛋白。臨床上主要用于降低膽固醇尤其是低密度脂蛋白-膽固醇,治療動(dòng)脈粥樣硬化,為冠心病、缺血性腦卒中預(yù)防和治療的有效藥物。患者使用他汀類藥品尤其需要警惕肌病和肝臟不良反應(yīng)。他汀相關(guān)性肌病臨床表現(xiàn)包括肌肉酸痛、肌炎和橫紋肌溶解,實(shí)驗(yàn)室檢查可見磷酸激酶升高;肝功能受損的表現(xiàn)為血清谷丙轉(zhuǎn)氨酶及谷草轉(zhuǎn)氨酶升高,肝酶增高多為一過性,多發(fā)生在開始治療或增加劑量的前3個(gè)月,一般停藥后肝酶水平即可下降?;颊咴谟盟幥皯?yīng)仔細(xì)閱讀藥品說明書不良反應(yīng)、注意事項(xiàng)、警示、禁忌等安全性提示信息,在服藥過程中如出現(xiàn)不適,應(yīng)及時(shí)與醫(yī)生或藥師聯(lián)系,避免發(fā)生嚴(yán)重不良反應(yīng)。
4.3 代謝及內(nèi)分泌系統(tǒng)用藥不良反應(yīng)監(jiān)測情況
代謝及內(nèi)分泌系統(tǒng)用藥是指治療內(nèi)分泌及代謝相關(guān)疾病的藥物,包括糖皮質(zhì)激素、糖尿病治療藥物、抗痛風(fēng)藥、甲狀腺疾病用藥、垂體疾病用藥等。近年來,代謝及內(nèi)分泌系統(tǒng)用藥不良反應(yīng)/事件報(bào)告數(shù)量及嚴(yán)重報(bào)告占比均呈現(xiàn)上升趨勢,提示應(yīng)對該類藥品風(fēng)險(xiǎn)給予更多關(guān)注。
2021年全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)共收到代謝及內(nèi)分泌系統(tǒng)用藥不良反應(yīng)/事件報(bào)告8.1萬份,其中嚴(yán)重報(bào)告7,422份,占9.2%。代謝及內(nèi)分泌系統(tǒng)用藥不良反應(yīng)/事件報(bào)告占2021年總體報(bào)告的4.1%。
4.3.1 涉及藥品情況
2021年代謝及內(nèi)分泌系統(tǒng)用藥不良反應(yīng)/事件報(bào)告數(shù)量排名前3位的藥品類別是糖皮質(zhì)激素、雙胍類、其他糖尿病治療藥物(除胰島素、促胰島素分泌藥、雙胍類、α-糖苷酶抑制藥、噻唑烷二酮類外的其他糖尿病治療藥物,下同),嚴(yán)重不良反應(yīng)/事件報(bào)告數(shù)量排名前3位的藥品類別分別是糖皮質(zhì)激素、胰島素、抗甲狀腺藥物。
2021年代謝及內(nèi)分泌系統(tǒng)用藥不良反應(yīng)/事件報(bào)告中,口服制劑占56.6%,注射劑占37.2%,其他劑型占6.2%。嚴(yán)重不良反應(yīng)/事件報(bào)告中,口服制劑占50.7%,注射劑占42.0%,其他劑型占7.3%。
4.3.2 累及器官系統(tǒng)情況
2021年代謝及內(nèi)分泌系統(tǒng)用藥不良反應(yīng)/事件報(bào)告中,總體報(bào)告和嚴(yán)重報(bào)告的藥品不良反應(yīng)/事件累及器官系統(tǒng)情況詳見圖11。與代謝及內(nèi)分泌系統(tǒng)用藥的總體報(bào)告相比,嚴(yán)重報(bào)告的藥品不良反應(yīng)/事件累及器官系統(tǒng)中,代謝及營養(yǎng)類疾病,各類神經(jīng)系統(tǒng)疾病,各類檢查,呼吸系統(tǒng)、胸及縱隔疾病,心臟器官疾病構(gòu)成比明顯偏高。
圖11 2021年代謝及內(nèi)分泌系統(tǒng)用藥不良反應(yīng)/事件累及器官系統(tǒng)
代謝及內(nèi)分泌系統(tǒng)用藥總體不良反應(yīng)/事件報(bào)告中,口服制劑累及器官系統(tǒng)排名前5位的是胃腸系統(tǒng)疾病、皮膚及皮下組織類疾病、代謝及營養(yǎng)類疾病、各類神經(jīng)系統(tǒng)疾病和全身性疾病及給藥部位各種反應(yīng);注射劑累及器官系統(tǒng)排名前5位是胃腸系統(tǒng)疾病、皮膚及皮下組織類疾病、代謝及營養(yǎng)類疾病、全身性疾病及給藥部位各種反應(yīng)、各類神經(jīng)系統(tǒng)疾病。
代謝及內(nèi)分泌系統(tǒng)用藥嚴(yán)重藥品不良反應(yīng)/事件報(bào)告中,口服制劑累及器官系統(tǒng)排名前5位是胃腸系統(tǒng)疾病、代謝及營養(yǎng)類疾病、皮膚及皮下組織類疾病、各類神經(jīng)系統(tǒng)疾病、各類檢查;注射劑累及器官系統(tǒng)排名前5位是代謝及營養(yǎng)類疾病、胃腸系統(tǒng)疾病、各類神經(jīng)系統(tǒng)疾病、皮膚及皮下組織類疾病、各類檢查。
4.3.3 監(jiān)測情況分析及安全風(fēng)險(xiǎn)提示
從報(bào)告絕對數(shù)量來看,糖尿病治療藥物報(bào)告數(shù)量與2020年相比的增幅最大;從各品種總報(bào)告和嚴(yán)重報(bào)告數(shù)量的排名來看,一些較新的糖尿病治療藥物(例如聚乙二醇洛塞那肽、度拉糖肽、達(dá)格列凈)排名上升較快。這一方面可能反映了我國人口老齡化和醫(yī)療保障水平提高等原因?qū)е绿悄虿“l(fā)病率和/或診斷率升高,從而引起糖尿病治療藥物使用人群的擴(kuò)大,另一方面也提示處方醫(yī)師和患者在選擇糖尿病治療藥物,尤其是較新的藥物時(shí)應(yīng)注意相關(guān)風(fēng)險(xiǎn)。
小貼士:
甲巰咪唑的嚴(yán)重不良反應(yīng)主要有哪些?
甲巰咪唑是一種硫脲類抗甲狀腺藥,是2018年版國家基本藥物目錄品種。甲巰咪唑的主要不良反應(yīng)包括血液學(xué)毒性、肝臟毒性和皮膚反應(yīng)。血液學(xué)毒性常見表現(xiàn)為白細(xì)胞減少和粒細(xì)胞減少;偶見嚴(yán)重的粒細(xì)胞缺乏癥,臨床表現(xiàn)為口腔炎、咽炎、發(fā)熱等,嚴(yán)重者可導(dǎo)致死亡;極少數(shù)病例中報(bào)告了全血細(xì)胞減少癥和再生障礙性貧血。肝毒性主要表現(xiàn)為肝功能檢查指標(biāo)升高,罕見肝衰竭,極少數(shù)病例中報(bào)告了膽汁淤積性黃疸和中毒性肝炎。皮膚反應(yīng)主要表現(xiàn)為皮疹和瘙癢,嚴(yán)重皮膚反應(yīng)包括全身性皮炎和紅斑狼瘡。還有一些嚴(yán)重但罕見的不良反應(yīng),包括胰腺炎、抗中性粒細(xì)胞胞漿抗體相關(guān)性小血管炎等。使用甲巰咪唑應(yīng)通過醫(yī)師處方,并按醫(yī)囑和說明書定期檢查血常規(guī)和肝功能,當(dāng)出現(xiàn)口腔炎、咽炎、發(fā)熱、厭食、惡心、上腹部疼痛、尿黃、皮膚或鞏膜黃染等癥狀時(shí)應(yīng)立即就醫(yī)。此外,甲巰咪唑可能導(dǎo)致先天畸形,育齡女性使用期間應(yīng)采用有效避孕措施,孕婦使用甲巰咪唑必須由醫(yī)師進(jìn)行嚴(yán)格的個(gè)體獲益/風(fēng)險(xiǎn)評估,且應(yīng)對孕產(chǎn)婦、胎兒和新生兒進(jìn)行密切監(jiān)測。
4.4 注射劑不良反應(yīng)監(jiān)測情況
2021年注射劑(不含疫苗)不良反應(yīng)/事件總體報(bào)告數(shù)量與2020年同期相比增長14.7%,在藥品總體報(bào)告中占比與近年來總體情況基本一致。按照劑型統(tǒng)計(jì),2021年藥品總體不良反應(yīng)/事件報(bào)告中注射劑(不含疫苗)占55.5%,嚴(yán)重報(bào)告中注射劑(不含疫苗)占70.9%。按藥品分類統(tǒng)計(jì),注射劑(不含疫苗)總體報(bào)告中化學(xué)藥品注射劑占87.8%,中藥注射劑占6.4%,生物制品占3.1%,無法分類者占2.7%;注射劑(不含疫苗)嚴(yán)重報(bào)告中化學(xué)藥品注射劑占87.4%,中藥注射劑占4.7%,生物制品占5.7%,無法分類者占2.2%。
4.4.1 藥品情況
化學(xué)藥品注射劑報(bào)告數(shù)量排名前3位的藥品類別是抗感染藥,腫瘤用藥,電解質(zhì)、酸堿平衡及營養(yǎng)藥(圖12)。
圖12 2021年化學(xué)藥品注射劑不良反應(yīng)/事件報(bào)告涉及藥品類別
中藥注射劑總體報(bào)告類別排名前5位的是理血?jiǎng)?、補(bǔ)益劑、開竅劑、清熱劑、祛痰劑(圖13)。
圖13 2021年中藥注射劑不良反應(yīng)/事件報(bào)告涉及藥品類別
4.4.2 累及器官系統(tǒng)情況
2021年注射劑總體不良反應(yīng)/事件報(bào)告中,累及器官系統(tǒng)排名前5位的是皮膚及皮下組織類疾病、胃腸系統(tǒng)疾病、全身性疾病及給藥部位各種反應(yīng)、各類神經(jīng)系統(tǒng)疾病和各類檢查。注射劑嚴(yán)重不良反應(yīng)/事件中,累及器官系統(tǒng)排名前5位的是血液及淋巴系統(tǒng)疾病、各類檢查、皮膚及皮下組織類疾病、全身性疾病及給藥部位各種反應(yīng)和胃腸系統(tǒng)疾?。▓D14)。

圖14 2021年注射劑不良反應(yīng)/事件累及器官系統(tǒng)
4.4.3 監(jiān)測情況分析及安全風(fēng)險(xiǎn)提示
從劑型統(tǒng)計(jì)情況看,2021年注射劑(不含疫苗)不良反應(yīng)/事件總體報(bào)告數(shù)量與2020年同期相比增長14.7%,在藥品總體報(bào)告中占比與近年來總體情況基本一致。從用藥人群統(tǒng)計(jì)情況看,兒童的注射劑(不含疫苗)不良反應(yīng)/事件報(bào)告數(shù)量與2020年同期相比增長19.7%,總體占比與近年來總體情況基本一致。根據(jù)注射劑監(jiān)測情況,建議臨床醫(yī)生用藥前仔細(xì)閱讀產(chǎn)品說明書,重點(diǎn)關(guān)注相關(guān)安全性內(nèi)容,處方前進(jìn)行充分的獲益與風(fēng)險(xiǎn)分析,始終遵照“能吃藥不打針,能打針不輸液”的用藥原則合理選擇用藥。兒童作為特殊用藥人群,受臟器發(fā)育尚未完全等因素影響,對藥物更為敏感,耐受性較差,更應(yīng)謹(jǐn)慎用藥。
小貼士:
怎樣合理選擇給藥途徑?
臨床上給藥途徑多種多樣,主要包括經(jīng)胃腸道給藥途徑和非經(jīng)胃腸道給藥途徑。經(jīng)胃腸道給藥途徑,即口服給藥途徑,常見劑型如片劑、顆粒劑、膠囊劑、散劑、溶液劑、丸劑等;非經(jīng)胃腸道給藥途徑,即除口服給藥途徑以外的所有其他途徑,如注射給藥、呼吸道給藥、皮膚給藥等,常見劑型如注射劑、噴霧劑、外用溶液劑、滴眼劑、栓劑等。其中,注射給藥途徑包括皮下注射、皮內(nèi)注射、肌內(nèi)注射、靜脈注射等。不同給藥途徑具有不同的臨床意義,如口服給藥途徑,是最常用,相對安全、方便、經(jīng)濟(jì)的給藥途徑;注射給藥途徑,優(yōu)點(diǎn)是吸收快,藥量準(zhǔn)確可控,缺點(diǎn)是未經(jīng)過人體的天然屏障,直接進(jìn)入體內(nèi),可引起組織損傷、疼痛、感染,甚至嚴(yán)重不良反應(yīng)。臨床上應(yīng)根據(jù)用藥實(shí)際,遵循“能口服給藥的,不選用注射給藥;能肌內(nèi)注射給藥的,不選用靜脈注射或滴注給藥”的原則,合理選擇給藥途徑。
第5章 有關(guān)說明
5.1 本年度報(bào)告中的數(shù)據(jù)來源于國家藥品不良反應(yīng)監(jiān)測數(shù)據(jù)庫中2021年1月1日至2021年12月31日各地區(qū)上報(bào)的數(shù)據(jù)。
5.2 與大多數(shù)國家一樣,我國藥品不良反應(yīng)報(bào)告是通過自發(fā)報(bào)告系統(tǒng)收集并錄入到數(shù)據(jù)庫中的,存在自發(fā)報(bào)告系統(tǒng)的局限性,如漏報(bào)、填寫不規(guī)范、信息不完善、無法計(jì)算不良反應(yīng)發(fā)生率等。
5.3 每種藥品不良反應(yīng)/事件報(bào)告的數(shù)量受到該藥品的使用量和不良反應(yīng)發(fā)生率等諸多因素的影響,故藥品不良反應(yīng)/事件報(bào)告數(shù)量的多少不直接代表藥品不良反應(yīng)發(fā)生率的高低或者嚴(yán)重程度。
5.4 本年度報(bào)告完成時(shí),其中一些嚴(yán)重報(bào)告、死亡報(bào)告尚在調(diào)查和評價(jià)的過程中,所有統(tǒng)計(jì)結(jié)果均為現(xiàn)階段數(shù)據(jù)收集情況的真實(shí)反映,并不代表最終的評價(jià)結(jié)果。
5.5 本年度報(bào)告統(tǒng)計(jì)時(shí)采用監(jiān)管活動(dòng)醫(yī)學(xué)詞典(MedDRA),既往采用世界衛(wèi)生組織不良反應(yīng)術(shù)語集(WHO-ART)。MedDRA是在人用藥品技術(shù)要求國際協(xié)調(diào)理事會(huì)(ICH)主辦下編制的標(biāo)準(zhǔn)化國際醫(yī)學(xué)術(shù)語集,用于與人用醫(yī)療產(chǎn)品相關(guān)的監(jiān)管溝通和數(shù)據(jù)評估。各類檢查是MedDRA中的一項(xiàng)系統(tǒng)器官分類,包括有限定詞(例如:升高、降低、異常、正常)和沒有限定詞的檢查名稱。
5.6 專業(yè)人士會(huì)分析藥品與不良反應(yīng)/事件的關(guān)聯(lián)性,提取藥品安全性風(fēng)險(xiǎn)信息,根據(jù)風(fēng)險(xiǎn)的普遍性或者嚴(yán)重程度,決定是否需要采取相關(guān)措施,如在藥品說明書中加入安全性信息,更新藥品如何安全使用的信息等。當(dāng)藥品的獲益不再大于風(fēng)險(xiǎn)時(shí),藥品也會(huì)撤市。
5.7 本年度報(bào)告數(shù)據(jù)均來源于全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò),不包含疫苗不良反應(yīng)/事件的監(jiān)測數(shù)據(jù)。



