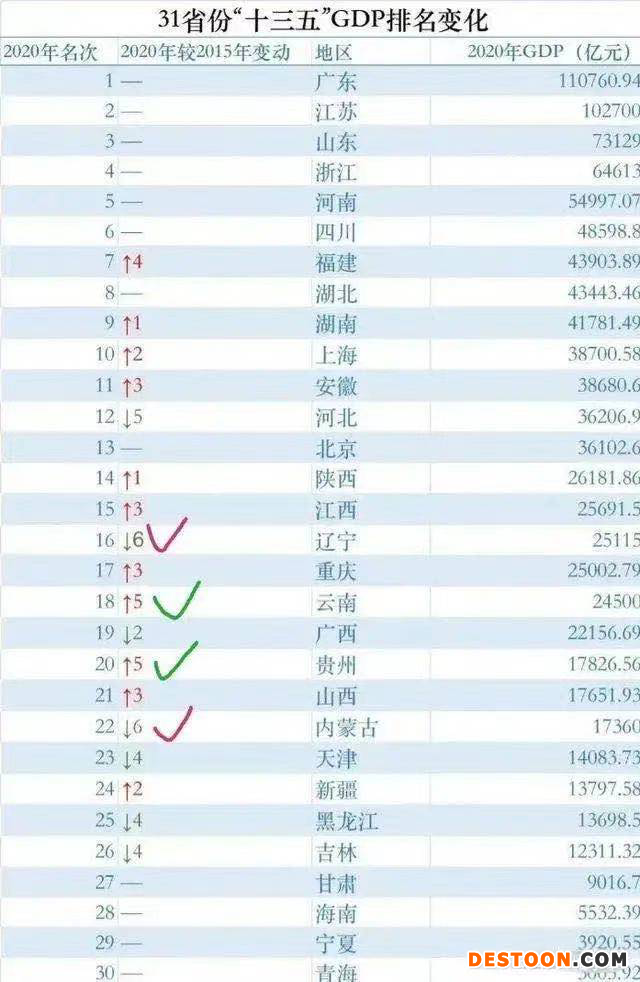
近日,2020年的GDP業(yè)績公布,廣東省以11萬億元繼續(xù)排名第一,和“十三五”初2015年的排名一樣。江蘇省以10億元屈居第二。然而,廣東的藥品研發(fā)并沒有如它的GDP那樣亮眼。
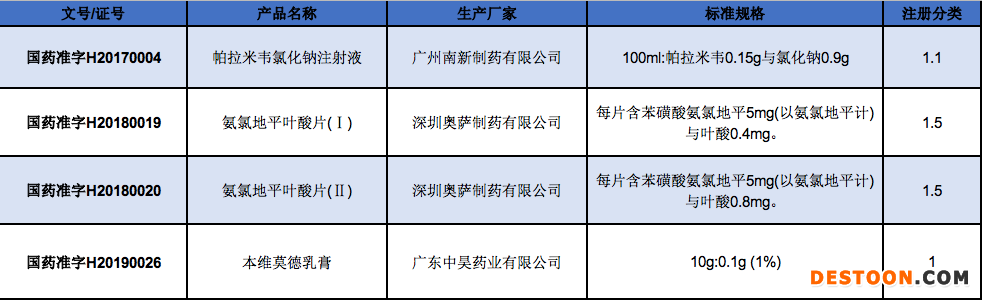

若以新藥品注冊(cè)管理辦法實(shí)施后獲批的產(chǎn)品作為評(píng)判研發(fā)能力的標(biāo)準(zhǔn),2017年以后,來自廣東化學(xué)藥獲批的1類新藥僅有3個(gè),若按新注冊(cè)分類,則只有1個(gè)獲批。獲得批文的三家廣東企業(yè),都不是進(jìn)入2019年度中國醫(yī)藥工業(yè)百強(qiáng)的企業(yè)。宜昌東陽光2020年獲批了一個(gè)1類新藥磷酸依米他韋膠囊,上市許可持有人地址屬于湖北省,該批文暫未統(tǒng)計(jì)在廣東省的批文范圍內(nèi)。

數(shù)據(jù)來源:咸達(dá)藥海數(shù)據(jù)庫
廣東的醫(yī)藥百強(qiáng)如今在做些什么?
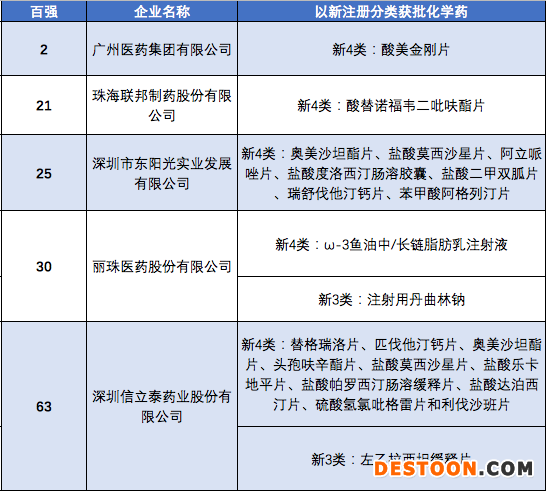
根據(jù)2019年度中國醫(yī)藥工業(yè)百強(qiáng)榜的數(shù)據(jù),廣東共有5家企業(yè)進(jìn)入百強(qiáng)榜,分別是廣州醫(yī)藥、聯(lián)邦制藥、東陽光藥、麗珠醫(yī)藥與信立泰。這五家近年以新注冊(cè)分類獲批的化學(xué)藥,基本上都是仿制藥。麗珠的注射用艾普拉唑鈉以舊2類在2017年獲批,是廣東頭部制藥企業(yè)為數(shù)不多的改良創(chuàng)新藥獲批。

數(shù)據(jù)來源:咸達(dá)藥海數(shù)據(jù)庫
如果不以獲批情況“論英雄”,廣東的1類化學(xué)藥新藥的申報(bào)情況是如何呢?或許我們能從中看出端倪。
首先,創(chuàng)新類的藥品獲批較少,直接原因是申報(bào)較少。以廣州醫(yī)藥集團(tuán)為例,廣藥僅申報(bào)了注射用頭孢嗪脒鈉一個(gè)產(chǎn)品,2017年獲批臨床,截至2020年,該藥在CDE中顯示的研發(fā)進(jìn)度是,啟動(dòng)注射用頭孢嗪脒鈉單次給藥安全性、耐受性及藥動(dòng)學(xué)研究的臨床研究。
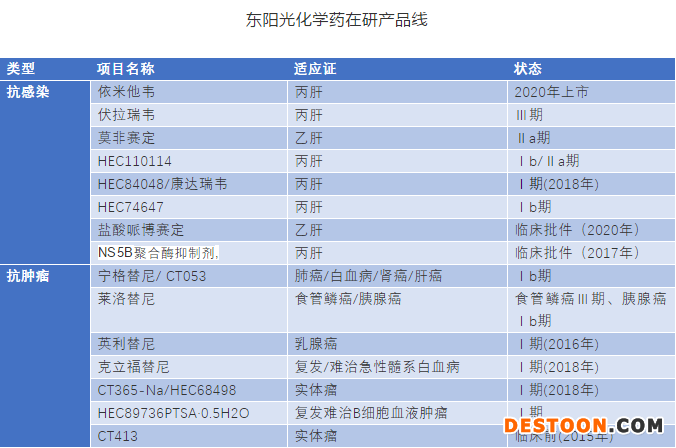
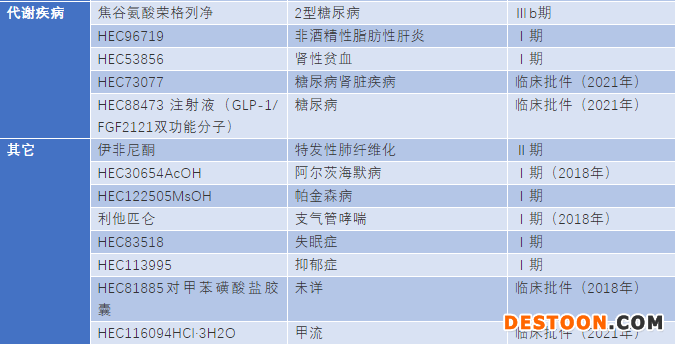
其次,創(chuàng)新藥的研發(fā)風(fēng)險(xiǎn)比較大也是不能回避的問題。以東陽光為例,作為廣東省1類化學(xué)藥申報(bào)最多的企業(yè),目前僅有一個(gè)治療丙肝的藥物依米他韋上市。根據(jù)研究進(jìn)度,下一步有可能上市的產(chǎn)品是處于臨床Ⅲ期的丙肝類藥物伏拉瑞韋和焦谷氨酸榮格列凈。其余藥物從進(jìn)度來看,還要至少等3年才能看到是否能上市。
另外值得關(guān)注的是,一些2017年沒有啟動(dòng)的臨床批件,2018年啟動(dòng)了臨床Ⅰ期,沒有進(jìn)一步進(jìn)展的,都很有可能是不會(huì)繼續(xù)的項(xiàng)目。按這樣的標(biāo)準(zhǔn)評(píng)估,東陽光可能已經(jīng)砍掉9個(gè)新藥項(xiàng)目。若以一個(gè)項(xiàng)目臨床前投入成本2500萬元,Ⅰ期臨床投入成本3500萬元估算,6個(gè)項(xiàng)目進(jìn)入Ⅰ期,3個(gè)臨床前。預(yù)計(jì)東陽光在研發(fā)項(xiàng)目的投入就將近3億元,此數(shù)據(jù)還未包括新藥研發(fā)五年的配套的原料藥、制劑和臨床的人力資源的投入。


數(shù)據(jù)來源:咸達(dá)藥海數(shù)據(jù)庫
2021年失敗的案例還有百奧泰。
2021年2月,百奧泰公告終止 BAT8001 (即注射用重組人源化抗 HER2 單克隆抗體-美登素偶聯(lián)物,以下簡稱“BAT8001”) 臨床試驗(yàn)。
2021年3月,百奧泰發(fā)布公告,稱其研發(fā)的 BAT8003 (即注射用重組人源化抗 Trop2 單克隆抗體-美登素偶聯(lián)物,以下簡稱“BAT8003”) 和 BAT1306(即重組人源化抗 PD-1 單克隆抗體注射液,以下簡稱“BAT1306”) 處于臨床研究階段。經(jīng)百奧泰審慎考量該藥物的后續(xù)開發(fā)風(fēng)險(xiǎn),決定終止該項(xiàng)目的臨床試驗(yàn)。
BAT8001針對(duì)HER2陽性乳腺癌的III期臨床研究是一項(xiàng)國內(nèi)多中心、隨機(jī)、開放、陽性對(duì)照、優(yōu)效性的Ⅲ期臨床研究。截至2020年百奧泰該項(xiàng)目研發(fā)投入累計(jì)2.26億元。
BAT8003是百奧泰自主開發(fā)的一種創(chuàng)新藥物,是一種靶向Trop2的ADC藥物,由糖基化修飾的重組人源化抗Trop2單克隆抗體通過定點(diǎn)偶聯(lián)技術(shù)與Batansine進(jìn)行共價(jià)連接而成。截至2020年12月31日,BAT8003項(xiàng)目研發(fā)投入累計(jì)6156.5萬元。
BAT1306是公司開發(fā)的針對(duì)免疫抑制檢查點(diǎn)PD-1的單克隆抗體,單藥適應(yīng)證為EBV相關(guān)性胃癌,目前已開展BAT1306聯(lián)合XELOX一線治療EBV相關(guān)胃癌臨床試驗(yàn)及BAT8001聯(lián)合BAT1306二線治療HER2陽性晚期實(shí)體瘤的臨床試驗(yàn)。截至2020年12月31日,BAT1306項(xiàng)目研發(fā)投入累計(jì)5197.45萬元。
第三,新藥研發(fā)周期較長,不確定性高。
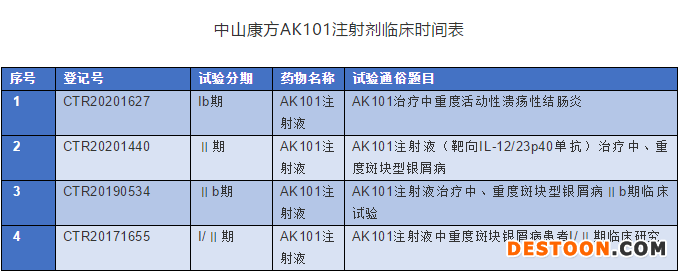
新藥的研發(fā)周期較長,按照目前國內(nèi)的法規(guī)要求,臨床前的研究信息只能從文獻(xiàn)和會(huì)議報(bào)道獲取。新藥獲得臨床批件后,理想狀態(tài)下,I期和Ⅱ期基本都需要1到2年,Ⅲ期需要2-3年。例如中山康方的生物制品AK101注射劑2017年9月獲批臨床,但是2020年還沒能正式啟動(dòng)Ⅲ期臨床研究。

來源:CDE
化學(xué)藥新注冊(cè)分類發(fā)布到2021年3月的時(shí)間太短,不足以支持產(chǎn)品完成臨床Ⅰ期、Ⅱ期到Ⅲ期整個(gè)完整的臨床研究。除了符合附條件上市的標(biāo)準(zhǔn)完成Ⅱ期臨床即可申報(bào)上市的新藥,其余新藥都要完成臨床研究Ⅲ期才能申報(bào)。
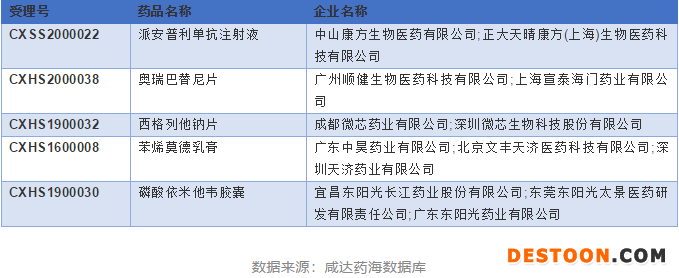
化學(xué)藥新注冊(cè)分類發(fā)布后,廣東共申報(bào)了五個(gè)1類新藥的上市申請(qǐng),其中上文提及的苯烯莫德乳膏和磷酸依米他韋膠囊已獲批上市。派安普利單抗注射液是廣東企業(yè)第一個(gè)也是唯一一個(gè)申報(bào)上市的PD-1注射液,申報(bào)上市時(shí)間為2020年。相較于2018年君實(shí)生物PD-1特瑞普利單抗注射液獲得國家藥監(jiān)局有條件批準(zhǔn)上市,成為了首個(gè)獲批上市的國產(chǎn)PD-1產(chǎn)品,整整慢了2年。
廣東一個(gè)省申報(bào)1類新藥上市的產(chǎn)品數(shù),比不上恒瑞一家申報(bào)的數(shù)量。

廣東的研發(fā)為啥遲遲不出成果?
廣東省是國內(nèi)藥品銷售市場規(guī)模最大的省,歷來都是各個(gè)藥企營銷必定布局的省份。但是近年來,廣東的藥品研發(fā)所展示的成績單遠(yuǎn)遠(yuǎn)比不上江蘇。
滬深股市中,化學(xué)制藥的市值排名(由高到低)中,2021年3月16日雪球數(shù)據(jù)展示,江蘇恒瑞以4737億排名第一,廣東省的信立泰和麗珠集團(tuán)分別以377億和335億分別排名第7和第10。
生物制品領(lǐng)域,廣東沒有一家上市企業(yè)的市值能擠進(jìn)前10。港股康方生物380億市值有擠進(jìn)前10的潛力。
廣東省之所以拼不過江蘇省,可能原因如下:
首先,廣東省只是一個(gè)省在戰(zhàn)斗,江蘇省和上海、浙江等省份緊密合作,已經(jīng)形成產(chǎn)業(yè)協(xié)同效應(yīng)。浙江省的原料藥出口經(jīng)過多年的積累,個(gè)別原料藥產(chǎn)品已經(jīng)是在全球具備成本優(yōu)勢。廣東省的企業(yè)大部分是國內(nèi)流通起家,醫(yī)藥流通改革前靠著政策紅利已經(jīng)活得很滋潤了,并沒有積極布局原料藥。廣東省附近的省份如福建也沒有像浙江省發(fā)展原料藥進(jìn)出口的生意,整個(gè)珠三角并沒有建立良好的原料藥基礎(chǔ)。原料藥的困境同樣也體現(xiàn)在CRO機(jī)構(gòu),廣東的CRO數(shù)量也沒有長三角的多。
其次,廣東企業(yè)更喜歡“取巧”。集中帶量采購后,成本管理具備競爭優(yōu)勢的原料制劑一體化企業(yè)更能夠獲得市場。沒有原料優(yōu)勢的廣東企業(yè)在競爭中更多是取巧勝出,例如第四次集采中花園藥業(yè)的招標(biāo)價(jià)格較高,贏得更高的市場規(guī)模引起行業(yè)熱議。這其實(shí)就是廣東藥品企業(yè)的文化——政策機(jī)會(huì)型企業(yè),政策導(dǎo)向在哪就往哪布局,更偏好讀懂規(guī)則后利用規(guī)則獲得更高的利潤。這意味著哪類項(xiàng)目短期收益回報(bào)越快,廣東企業(yè)就更愿意投入,重資產(chǎn)回報(bào)慢的項(xiàng)目往往在廣東不受青睞。
第三,政府的投入。廣州和深圳這兩年終于啟動(dòng)生物醫(yī)藥的搶人搶項(xiàng)目的戰(zhàn)爭。但是生物制品越到研發(fā)后期越難變更生產(chǎn)產(chǎn)地,也就是說廣東省已經(jīng)錯(cuò)過了PD-1、CAR-T最佳的發(fā)展階段,百濟(jì)神州雖然在廣州有生產(chǎn)基地,但并不是其總部,研發(fā)核心也不在廣州。這意味著未來三年的行業(yè)的生物制品的亮點(diǎn)業(yè)績基本與廣東無關(guān)。ADC、雙抗、核酸藥物或許還有爭奪的機(jī)會(huì),其中中山康方可能在雙抗領(lǐng)域有所突破。
第四,人才的缺乏。廣東藥品相關(guān)的研發(fā)高校并不多,實(shí)力最強(qiáng)的可能就是中山大學(xué)。中國藥科大學(xué)每年畢業(yè)的學(xué)生通常會(huì)優(yōu)先選擇長三角,流到珠三角的人才并不多。廣東最近的高校實(shí)力較強(qiáng)的中南大學(xué)(湘雅醫(yī)學(xué)院)和湖北武漢兩大領(lǐng)域也沒有緊密的合作和人力的引流。
高技術(shù)型人才方面,廣東研發(fā)人員的薪酬和長三角對(duì)比并沒有優(yōu)勢,這主要是廣東的現(xiàn)有的藥企的營業(yè)收入水平一般,而且大部分廣東的老板非常講究年度利潤業(yè)績,根據(jù)自己的利潤體量去測算研發(fā)團(tuán)隊(duì)的薪酬。
此外,廣東的老板大多數(shù)不是研發(fā)出身而是市場營銷出身,往往用營銷市場的管理方法去管理研發(fā)團(tuán)隊(duì),營銷團(tuán)隊(duì)往往講究的狼群效應(yīng),更愿意獎(jiǎng)勵(lì)頭狼,但是研發(fā)更講究的是合作,每一個(gè)環(huán)節(jié)都要達(dá)標(biāo),必須要和諧共贏的氛圍,老板如果沒有把關(guān)鍵核心環(huán)節(jié)的關(guān)鍵人員都照顧好,很難出成果。因此,廣東可能會(huì)出成果的企業(yè)只能期待是有技術(shù)并且有市場觸覺的大?;貋?strong>創(chuàng)業(yè)。



