近日,廣東發(fā)布《超藥品說明書用藥目錄(2023版)》,共納入169個藥品,涉及308條用藥信息,重點破解兒科藥短缺、抗腫瘤/抗菌耐藥等臨床用藥難題。其中,10個品種超說明書適應癥達5項及以上,4款單抗位居前列,不乏2022年全球銷售額超200億美元的重磅炸彈,以及正大天晴藥業(yè)、信達生物、羅氏等在中國公立醫(yī)療機構終端超46億元的潛力品種。超藥品說明書用藥已寫入法條,四個前提條件及三大用藥需求值得關注。
169個藥品解鎖“新用法”,解困兒科藥短缺、抗腫瘤/抗菌耐藥......
“超說明書用藥”是指超出藥品說明書所標明的適應癥范圍而用藥的行為。
2021年8月,國務院正式發(fā)布《中華人民共和國醫(yī)師法》,于2022年3月1日正式施行,并首次將診療指南和循證醫(yī)學證據(jù)下的超說明書用藥寫入法條。這意味著,對容易引發(fā)醫(yī)患糾紛的“超說明書用藥”問題從法律層面進行了規(guī)范,賦予醫(yī)生“超說明書用藥”的自主權,超說明書用藥從此有了法律保障。
今年7月,廣東省藥學會發(fā)布《超藥品說明書用藥目錄(2023版)》(下文簡稱2023版目錄),共納入169個藥品(文末附品種名單)。
與2022版相比,新版目錄增加了64條用藥信息,涉及來那度胺、侖伐替尼等抗腫瘤大品種,和依維莫司、鹽酸魯拉西酮、甘精胰島素等超說明書用于兒科領域的藥品。同時,新版目錄也刪減了25條用藥信息,涉及帕羅西汀(廣泛性焦慮障礙、創(chuàng)傷后應激障礙)、普瑞巴林(癲癇發(fā)作輔助治療)、氯沙坦鉀(慢性心力衰竭)等品種。
臨床用藥端都存在一個共識,藥品說明書在治療方案面前存在著難以替代解決的滯后性,藥品的超說明書使用規(guī)范化,無疑有助于供應短缺的兒科藥、易產(chǎn)生耐藥的抗腫瘤藥及抗菌藥等臨床用藥需求的選擇。
來那度胺是由新基制藥(后被BMS收購)開發(fā),是全球治療多發(fā)性骨髓瘤的金標準口服藥物。此次2023版目錄允許該藥超說明書用于:①與利妥昔單抗聯(lián)合邊緣區(qū)淋巴瘤(MZL);②含硼替佐米治療后,復發(fā)或進展的套細胞淋巴瘤(MCL)。顯然,這對相關腫瘤耐藥患者而言是一大福音。
米內(nèi)網(wǎng)數(shù)據(jù)顯示,來那度胺2022年在全球銷售規(guī)模接近100億美元,而在中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端銷售額突破12億元,同比增長8.19%。目前,來那度胺膠囊已有10款仿制藥獲批上市,并通過一致性評價,有望成為新一輪國采中企業(yè)角逐的熱品。
近年來中國公立醫(yī)療機構終端來那度胺銷售趨勢(單位:萬元)
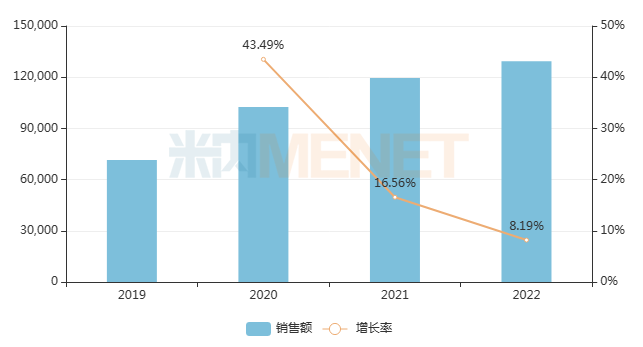
來源:米內(nèi)網(wǎng)中國公立醫(yī)療機構藥品終端競爭格局
依維莫司由諾華研發(fā),是FDA批準的首個mTOR抑制劑,臨床用于預防心/腎移植術患者移植物排異、乳腺癌、結節(jié)性硬化癥等,2022年全球銷售額超8億美元。
2023版目錄新增依維莫司可超說明書用于結節(jié)性硬化癥(TSC)相關部分性癲癇的2歲及以上兒童患者的輔助治療,有望進一步滿足兒科罕見病領域的用藥需求。
值得一提的是,目前該藥首仿尚未決出,正大天晴藥業(yè)、華東醫(yī)藥、海正醫(yī)藥等7家企業(yè)的上市申請已在審評審批中。
依維莫司片企業(yè)申報上市情況

來源:米內(nèi)網(wǎng)中國申報進度(MED)數(shù)據(jù)庫
適應癥TOP10品種出爐!涉及正大天晴、信達生物、默沙東......
2023版目錄中,超說明書適應癥達5項及以上的品種有10個。從治療亞類上看,抗腫瘤藥為主力,占據(jù)8個席位,其余2個為精神安定藥。
2023版目錄適應癥TOP10品種
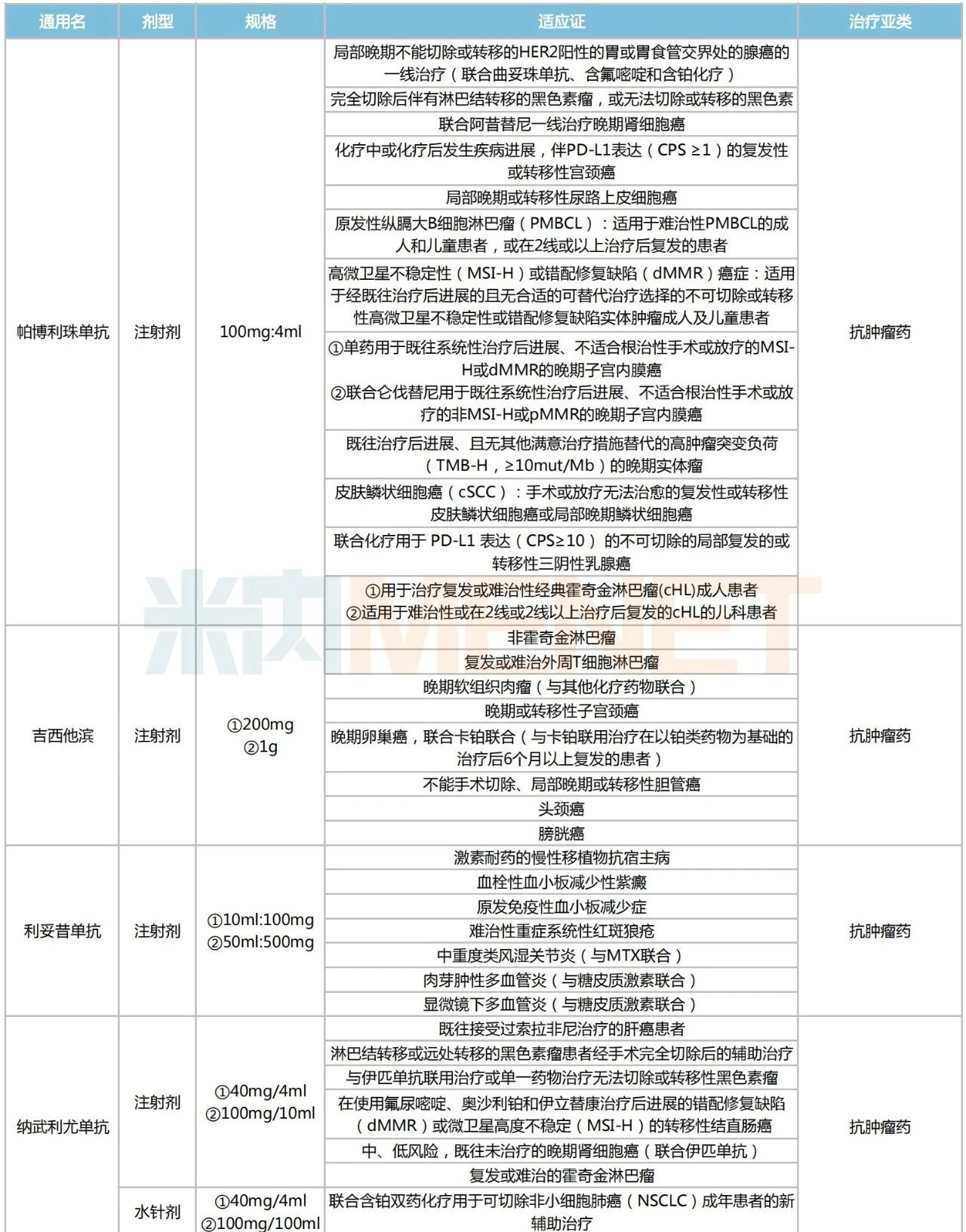

來源:廣東省藥學會官網(wǎng),米內(nèi)網(wǎng)整理
適應癥TOP10品種中,帕博利珠單抗、吉西他濱、利妥昔單抗、納武利尤單抗及伊匹木單抗5個抗腫瘤藥以6個及以上超說明書適應癥位居前列。
帕博利珠單抗(俗稱K藥)是一款當紅的抗腫瘤PD-(L)1單抗,至今獲批適應癥超40項,覆蓋黑色素瘤、非小細胞肺癌、淋巴瘤等20多個癌種,2022年其全球銷售額超過200億美元。2023版目錄中,該藥新增超說明書適應癥多達8項,包括兒童/成人難治性縱膈大B細胞淋巴瘤(PMBCL)、高微衛(wèi)星不穩(wěn)定性(MSI-H)或錯配修復缺陷(dMMR)癌癥等,將為更多腫瘤患者提供了新的用藥選擇。
近年來帕博利珠單抗全球銷售趨勢(單位:億美元)
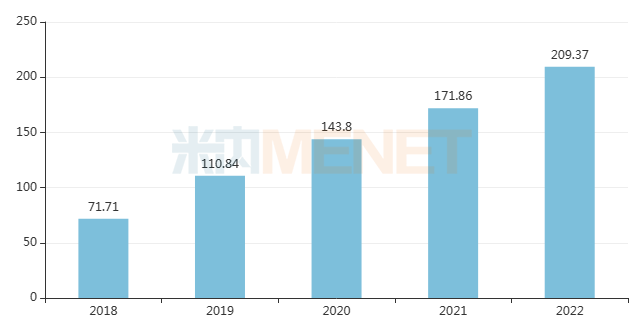
來源:米內(nèi)網(wǎng)跨國上市公司數(shù)據(jù)庫
利妥昔單抗是由羅氏研發(fā)的一款靶向CD20的治療性單克隆抗體,為全球首個抗腫瘤靶向單抗藥物。米內(nèi)網(wǎng)數(shù)據(jù)顯示,該藥2022年在中國公立醫(yī)療機構終端銷售規(guī)模超過46億元,目前已有正大天晴藥業(yè)、上海復宏漢霖及信達生物3家企業(yè)的生物類似藥獲批上市。
據(jù)統(tǒng)計,利妥昔單抗在國內(nèi)已獲批非霍奇金淋巴瘤、濾泡中心淋巴瘤、慢性淋巴細胞白血病等4項適應癥,而在2023版目錄中,該藥被允許超說明書用于多個免疫疾病的治療,涉及系統(tǒng)性紅斑狼瘡、類風濕關節(jié)炎、肉芽腫性多血管炎等,有望推動其銷售市場的擴容。
利妥昔單抗在中國獲批及在研適應癥情況
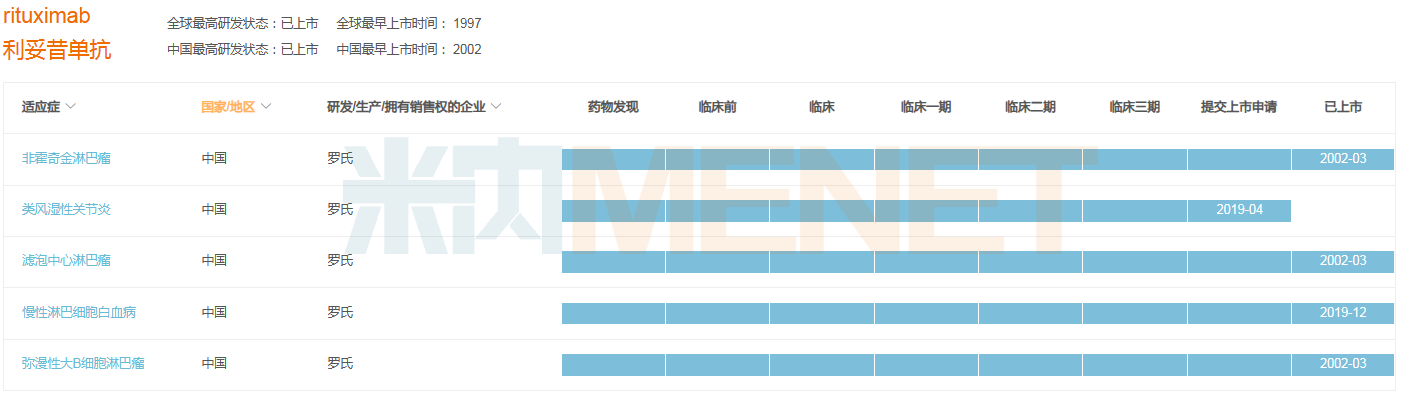
來源:米內(nèi)網(wǎng)全球藥物研發(fā)數(shù)據(jù)庫
吉西他濱是非小細胞肺癌、胰腺癌及乳腺癌等癌種的一線用藥,2023版目錄中,該藥可超藥品說明書用于非霍奇金淋巴瘤、膽管癌、膀胱癌等細分癌種的治療,可見其產(chǎn)品潛力十足。
納武利尤單抗(俗稱O藥)在2023版目錄中新增了1條超說明用藥信息——聯(lián)合含鉑雙藥化療用于可切除非小細胞肺癌(NSCLC)成年患者的新輔助治療,將進一步滿足不同臨床需求的NSCLC患者。
2021年6月,伊匹木單抗(俗稱Y藥)聯(lián)合納武利尤單抗(被譽為“免疫雙子星”)獲批用于非上皮樣惡性胸膜間皮瘤,成為中國首個且唯一的雙免疫療法。此前,“O+Y”組合療法也曾獲FDA批準用于肝癌、腎癌、非小細胞肺癌等,不難發(fā)現(xiàn),上述療法被納入2023版目錄也是有據(jù)可循。
“四個前提”缺一不可,“三大需求”值得探索
藥品超說明書使用寫入法條是件好事,體現(xiàn)了尊重科學、尊重實踐的精神,把責任界限劃清楚,才能盡可能地將醫(yī)療事業(yè)做得更和諧,但也不能盲目的依照超說明書用藥內(nèi)容照本宣科,而是把超說明書用藥的前提與合理性界定清楚。
仔細審讀新版《醫(yī)師法》的條文,可以發(fā)現(xiàn)四大前提條件,缺一不可:①藥品具有循證醫(yī)學證據(jù);②沒有其他更安全有效、經(jīng)濟合理的治療手段;③患者知情同意;④醫(yī)院建立了相關的管理機制。
隨著法律的完善,藥學會及相應醫(yī)療機構對超說明書用藥的規(guī)范管理將逐步建立。超說明書用藥不是醫(yī)生的個人行為,而是歸屬于醫(yī)療機構層面的一種診療行為,需要建立管理制度來嚴格規(guī)范用藥行為,比如處方審核、臨床會診等,醫(yī)生本人則需要在超說明書用藥時上報院方備案,由院方進行定期評估、防控風險。
超說明書用藥的規(guī)范化,讓我們看到一切以臨床需求為導向、以患者利益為根本目的的內(nèi)容都是值得被鼓勵的。同樣,我們也需以正確的眼光來看待超說明書用藥,充分探索它的發(fā)展及未來。
首先要明白,超說明書用藥的根本是為了疾病治療的需要。
臨床醫(yī)學在探索、發(fā)現(xiàn)中不斷前進,其發(fā)展對治療藥物提出新的需求:要么開發(fā)新的藥物;要么在已有藥物中發(fā)現(xiàn)新的用途。對于后者,超說明書用藥將不可避免,這也在某種程度上促進了臨床藥學的發(fā)展。
其次,在一定程度上打破兒科藥的局限性。
超說明書用藥包括超出說明書適應癥、適用年齡、給藥途徑及劑量的用藥,在兒科領域相對使用更多。因為兒童(尤其是新生兒)器官功能不成熟、藥物吸收情況不易明確,藥物臨床試驗難開展,通過審批的兒科藥本就不多。為治療患兒,超說明書用藥也是其中一種解題途徑。
再者,盡可能地彌補說明書的滯后性。
醫(yī)藥學學科是實踐科學,而藥品說明書總是滯后于醫(yī)藥學的實踐和發(fā)展,以至于藥品說明書的內(nèi)容具有滯后性和不完整性的特點。隨著藥品上市,臨床用藥經(jīng)驗的積累,藥品說明書的內(nèi)容也需要更新。但是,由于藥品說明書修訂起來和法律的修訂一樣,需要一定的周期,有時難以與臨床用藥同步進展,超說明書用藥更能滿足臨床患者需求、填補治療空白。
結語
總體而言,超說明書用藥可能會帶來一些風險,但如果能夠得到嚴格監(jiān)管,在流程合法合規(guī)、確保安全性的前提下,讓更多藥物的“新用法被解鎖”,惠及更多的用藥患者,又何樂而不為呢?
來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、廣東省藥學會官網(wǎng)
注:米內(nèi)網(wǎng)《中國公立醫(yī)療機構藥品終端競爭格局》,統(tǒng)計范圍是:中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院,不含民營醫(yī)院、私人診所、村衛(wèi)生室;上述銷售額以產(chǎn)品在終端的平均零售價計算。數(shù)據(jù)統(tǒng)計截至7月25日,如有疏漏,歡迎指正!

