10月28日訊 醫(yī)保局已經(jīng)明確將適時(shí)開展生物類似藥帶量采購。生物類似藥能否在我國臨床市場上取代原研生物藥,主要核心在三方面,一是醫(yī)保支付,二是醫(yī)院覆蓋,三是醫(yī)生處方。但對企業(yè)而言,能否贏得集采,關(guān)鍵還是價(jià)格。
01.生物類似藥按集采“仿制藥”管理?
2020年10月9日,國家醫(yī)療保障局對十三屆全國人大三次會(huì)議第6450號建議的答復(fù)提到,“我局正在研究生物制品集中采購相關(guān)政策,生物類似藥并非集中帶量采購的禁區(qū),在考慮生物類似藥的相似性、企業(yè)產(chǎn)能和供應(yīng)鏈的穩(wěn)定性、具體產(chǎn)品的臨床可替代性等因素的基礎(chǔ)上,將適時(shí)開展集中帶量采購”。
答復(fù)也提到,按照《關(guān)于將2019年談判藥品納入乙類范圍的通知》,“有效期限內(nèi)如有其他生產(chǎn)企業(yè)的同通用名稱藥品(仿制藥)上市,自動(dòng)屬于目錄范圍,醫(yī)保部門有權(quán)根據(jù)仿制藥價(jià)格調(diào)整醫(yī)保支付標(biāo)準(zhǔn),也有權(quán)將該通用名藥品納入集中采購范圍。如修美樂(阿達(dá)木單抗)的仿制藥已納入醫(yī)保支付范圍”。這意味著生物類似藥也被視為“仿制藥”管理。
早在2017年3月,國家藥典委員會(huì)發(fā)布關(guān)于對"生物制品通用名命名原則規(guī)程"征求意見的通知,規(guī)范生物制品通用名方法,生物類似藥命名和原研無區(qū)別,為生物制品可以從通用名上取代原研藥品打下基礎(chǔ)。
我國在生物類似藥的政策扶持稍顯“遲到”,直到2017年12月,國家發(fā)改委發(fā)布《增強(qiáng)制造業(yè)核心競爭力三年行動(dòng)計(jì)劃(2018-2020年)》的通知,才明確首家生物類似藥為高端藥品。鼓勵(lì)市場潛力大、臨床價(jià)值高的專利到期,首家生物類似藥的開發(fā)及產(chǎn)業(yè)化。
我國在研的生物類似藥的靶點(diǎn)主要包括CD20、EFGR、VEGF、TNF、RANKL和HER2。涉及包括阿達(dá)木單抗、貝伐珠單抗、曲妥珠單抗、利妥昔單抗、依那西普、英夫利昔單抗、地舒單抗、非格司亭、培非格司亭、雷珠單抗、奧馬珠單抗等近50個(gè)原研藥物。
自2015年食品藥品監(jiān)管總局發(fā)布《生物類似藥研發(fā)與評價(jià)技術(shù)指導(dǎo)原則(試行)》以來,2019年起終于發(fā)表了一系列具體產(chǎn)品的生物類似藥臨床試驗(yàn)設(shè)計(jì)指導(dǎo)原則。生物類似藥臨床試驗(yàn)設(shè)計(jì)指導(dǎo)原則主要針對的是生物類似藥的上市標(biāo)準(zhǔn)。指導(dǎo)原則發(fā)布了,生物類似藥獲批的標(biāo)準(zhǔn)才有,生物類似藥才有可能獲批。
02.兩個(gè)生物類似藥具備集采條件
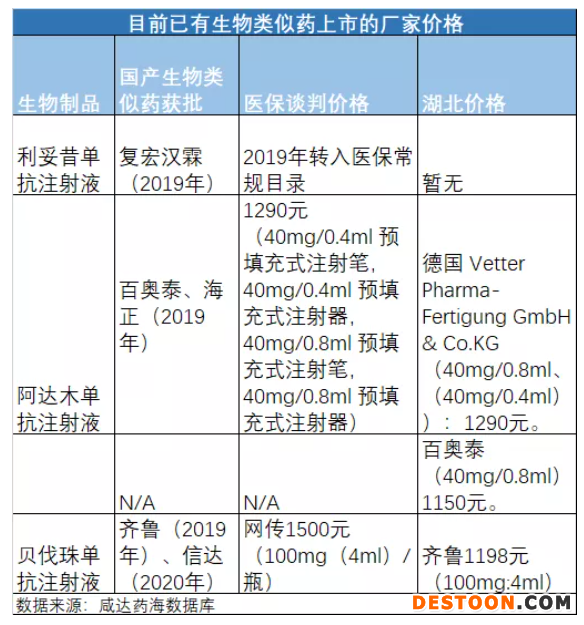
2019年以來,共有4個(gè)產(chǎn)品的生物類似藥獲批,分別是利妥昔單抗注射液、阿達(dá)木單抗注射液、曲妥珠單抗注射液和貝伐珠單抗注射液。利妥昔單抗注射液2019年已經(jīng)轉(zhuǎn)入醫(yī)保常規(guī)目錄。阿達(dá)木單抗注射液、曲妥珠單抗注射液和貝伐珠單抗注射液都在2019年談判成功藥品名單,這意味著上述三者的同通用名生物類似藥都已納入醫(yī)保支付范圍。
復(fù)宏漢霖和信達(dá)藥業(yè)各有2個(gè)生物類似藥獲批,是國內(nèi)目前獲批生物類似藥最多的廠家。阿達(dá)木單抗注射液(商品名:修美樂)和貝伐珠單抗注射液(商品名:安維?。┑纳镱愃扑幖霸袕S家數(shù)已經(jīng)到達(dá)集中采購的門檻——3家,理論上可以進(jìn)行集中采購了。

2019年進(jìn)入醫(yī)保談判目錄的單抗類產(chǎn)品有康柏西普、阿柏西普、西妥昔單抗、貝伐珠單抗、尼妥珠單抗、曲妥珠單抗、帕妥珠單抗、信迪利單抗、阿達(dá)木單抗、英夫利西單抗、奧馬珠單抗、雷珠單抗,除了康柏西普、西妥昔單抗、信迪利單抗和阿達(dá)木單抗有公布談判價(jià)格外,其余產(chǎn)品皆無公布談判價(jià)格。
醫(yī)保談判產(chǎn)品在醫(yī)保談判成功后由于價(jià)格已經(jīng)明確,通常都是在采購平臺掛網(wǎng)采購,生物類似藥上市后也是掛網(wǎng)采購。但是不是所有生物類似藥都能成功掛網(wǎng)采購。以湖北為例,《湖北省藥品采購準(zhǔn)入結(jié)果(第六批)》只有一家生物類似藥,為齊魯?shù)呢惙ブ閱慰棺⑸湟海瑘?bào)價(jià)1198元,齊魯2019年在其他省份的上市價(jià)格為1266元?!逗笔∷幤凡少彍?zhǔn)入公示表(第七批)》提到信達(dá)進(jìn)入掛網(wǎng)采購,但是沒有公布信達(dá)的價(jià)格
百奧泰的阿達(dá)木單抗注射液曾在天津報(bào)價(jià)1160元,在《湖北省藥品采購準(zhǔn)入結(jié)果(第六批)》沒有成功掛網(wǎng),《湖北省藥品采購準(zhǔn)入公示表(第七批)》的價(jià)格為1150元,有望成功掛網(wǎng)。
目前業(yè)界認(rèn)為短期內(nèi)最有可能集中采購的品類是胰島素類生物制品。2020年1月9日,包括諾和諾德、禮來、通化東寶、聯(lián)邦制藥等10家胰島素生產(chǎn)企業(yè)參與了武漢市的帶量采購招標(biāo)會(huì),這是胰島素第一次被納入集中采購的品類范圍。按胰島素起效時(shí)間分為7組進(jìn)行議價(jià)后,僅有諾和諾德、江蘇禮來及通化東寶、合肥天麥入圍。預(yù)計(jì)市場主要由諾和諾德、禮來和通化東寶三家瓜分。武漢模式非常有可能是作為試點(diǎn)模式而被全國借鑒。
03.生物類似藥集中采購的難點(diǎn)是什么?
生物類似藥能否取代原研產(chǎn)品,醫(yī)保局明確了需要考慮的是生物類似藥的相似性、企業(yè)產(chǎn)能和供應(yīng)鏈的穩(wěn)定性、具體產(chǎn)品的臨床可替代性等因素的基礎(chǔ)上,將適時(shí)開展集中帶量采購。
2020年8月,CDE發(fā)布了關(guān)于公開征求《生物類似藥相似性評價(jià)和適應(yīng)癥外推技術(shù)指導(dǎo)原則(征求意見稿)》,其提到的“相似性”是指:生物類似藥與參照藥之間高度相似,在純度、安全性及有效性不存在有臨床意義的差別。整體相似性評價(jià)需要根據(jù)藥學(xué)、非臨床及臨床比對試驗(yàn)結(jié)果綜合評價(jià),如候選藥和參照藥微小的質(zhì)量差異未發(fā)現(xiàn)對安全性、有效性和免疫原性等存在影響的,則可以認(rèn)為候選藥與參照藥整體相似。實(shí)際上這些研究基本上在注冊申報(bào)的時(shí)候都需要開展,因此從相似性考慮,基本上都可以替代。
目前對生物類似藥臨床用藥的可互換性的主要擔(dān)憂來自于安全性:不少利益相關(guān)方認(rèn)為互換生物類似藥可能增加不同的免疫原性反應(yīng)和不良反應(yīng),影響患者用藥安全。與此同時(shí),也有越來越多的證據(jù)表明生物類似藥不良反應(yīng)是由于藥物配方之間的差異以及不適當(dāng)?shù)馁A存和運(yùn)輸條件造成的,藥物之間的互換不會(huì)增加免疫原性反應(yīng)。歐盟更是在指南中指出,通過10年的臨床證據(jù)表明,EMA批準(zhǔn)的生物類似藥可以作為其他生物制劑在其所有批準(zhǔn)的適應(yīng)證中安全有效地使用。
日前,國際仿制藥協(xié)會(huì)呼吁精簡全球生物類似藥開發(fā)和審批流程。其中,上文提及的證明“相似性”方面的研究,特別是證明比對臨床療效的要求在生物類似藥的整體監(jiān)管評價(jià)和決策過程中的價(jià)值有限。文件中引用了一項(xiàng)回顧性研究,研究顯示歐盟和美國批準(zhǔn)的所有生物類似藥開發(fā)計(jì)劃的比對療效研究均得出了比對療效的確證性結(jié)果。
在 95% 的生物類似藥開發(fā)計(jì)劃中,比對療效研究沒有為審評過程增加任何科學(xué)價(jià)值。在剩余 5% 的計(jì)劃中,建立了比對療效,但在免疫原性率上存在差異,在批準(zhǔn)之前需要改進(jìn)生產(chǎn)工藝。重要的是,這些結(jié)果是在 2010 年之前開發(fā)的生物類似藥中觀察到的,此后在生物類似藥開發(fā)計(jì)劃中,未觀察到臨床療效和安全性(包括免疫原性)方面的差異。盡管比較臨床療效研究在監(jiān)管決策中價(jià)值有限,但“監(jiān)管機(jī)構(gòu)很少免除對這些研究的需求。”
藥品之間可以互換是指將一種藥物替換成預(yù)期具有相同臨床效果的另一種藥物,這意味著可用生物類似藥替換原研藥品 (反之亦然)或用某種生物類似藥替換另一種生物類似藥。可互換的生物類似藥包括下述屬性:1)生物類似藥是原研生物藥的類似物;2)生物類似藥預(yù)期在任何患者身上產(chǎn)生與原研藥同樣的臨床效果;3)和生物類似藥在同一患者效果遞減的風(fēng)險(xiǎn)不比原研藥更高。4)可互換的生物類似藥可以不經(jīng)醫(yī)生的干預(yù)就可以與原研藥互換。
美國認(rèn)為生物類似藥的可互換性可能就要補(bǔ)充試驗(yàn):生物仿制藥與原研生物藥之間的兩次或更多次的替換是否影響治療過程的安全性或療效。臨床試驗(yàn)如何設(shè)計(jì),真實(shí)世界數(shù)據(jù)的研究是否可以作為佐證,一切都還是在摸索中。生物類似藥上市所需要做的3期臨床研究成本就很高,如果還需要做可互換性試驗(yàn)來論證可行性,無疑是為生物類似藥的使用再加多一道門檻,這種門檻主要利好的是原研廠家。
生物類似藥能否互換,在臨床用藥上通常有轉(zhuǎn)換和替代2種形式。
轉(zhuǎn)換形式指的是處方醫(yī)生決定用某種具有相同治療目的的一種藥物替換另一種藥物,也包括了集中采購政策或臨床供應(yīng)等客觀原因,對臨床醫(yī)生的處方自由構(gòu)成管理限制,從而發(fā)生的轉(zhuǎn)換。集中采購如果將生物類似藥納入名單,這意味著生物類似藥有望從臨床供應(yīng)上完成和原研的轉(zhuǎn)換。
替代形式是指不咨詢處方醫(yī)生的情況下,在藥房終端分配同通用名的生物制品時(shí)原研藥品和生物類似藥之間的替代,自動(dòng)替代在化學(xué)仿制藥是常見的,但是生物類似藥由于其特殊性,目前用藥指導(dǎo)原則沒有認(rèn)可自動(dòng)替代。
04.價(jià)格戰(zhàn)會(huì)到來嗎?
生物類似藥能否在我國臨床市場上取代原研生物藥,主要核心在三方面,一是醫(yī)保支付,二是醫(yī)院覆蓋,三是醫(yī)生處方。
國家醫(yī)療保障局對十三屆全國人大三次會(huì)議第6450號建議的答復(fù)明確了按通用名確定的醫(yī)保目錄以及對應(yīng)的醫(yī)保藥品支付標(biāo)準(zhǔn)中,生物類似藥和原研藥品屬于同通用名,理論上可以相互替換。
生物制品特別是生物類似藥如果可以集中采購,生物類似藥可以在中標(biāo)省份醫(yī)療機(jī)構(gòu)取代原研藥品。
醫(yī)生處方方面,2020年5月15日,由中國臨床腫瘤學(xué)會(huì)(CSCO)中國抗淋巴瘤聯(lián)盟主辦的中國生物類似藥專家共識發(fā)布會(huì)成功舉行,北京大學(xué)腫瘤醫(yī)院朱軍教授、上海交通大學(xué)附屬瑞金醫(yī)院沈志祥教授、哈爾濱血液病腫瘤研究所所長馬軍教授與中國醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院石遠(yuǎn)凱教授擔(dān)任本次會(huì)議主席。會(huì)上正式發(fā)布了首部《中國生物類似藥專家共識》。從共識來看,目前主要由處方醫(yī)生決定了患者是否可以轉(zhuǎn)換生物類似藥,由于生物類似藥的用藥積累經(jīng)驗(yàn)不足,預(yù)計(jì)前期仍然是個(gè)性化藥物治療為主。
無論是從醫(yī)保政策還是集中采購、臨床用藥指南,都為生物類似藥在臨床上取代原研藥提供依據(jù)。隨著我國生物類似藥的產(chǎn)品的陸續(xù)獲批,生物類似藥的價(jià)格戰(zhàn)也不遠(yuǎn)了。



 110102000668(1)號
110102000668(1)號