8月18日訊 8月15日,片仔癀發(fā)布公告稱,1類新藥PZH2109膠囊申報(bào)臨床獲得CDE受理,該藥品主要用于治療非酒精性脂肪性肝炎,美國和中國暫無相同靶點(diǎn)相同適應(yīng)癥的藥品獲批上市。
圖1:片仔癀1類新藥的申報(bào)情況
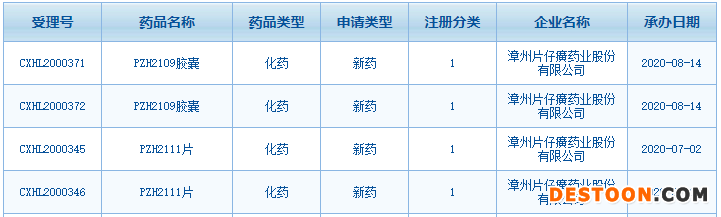
來源:CDE官網(wǎng)
片仔癀憑借三大獨(dú)家中成藥片仔癀、片仔癀膠囊、茵膽平肝膠囊稱霸肝炎中成藥零售市場(chǎng),近年來公司在研發(fā)上瞄準(zhǔn)了化藥市場(chǎng),2020年7月1類新藥PZH2111片申報(bào)臨床獲得受理,該產(chǎn)品主要用于治療肝內(nèi)膽管細(xì)胞癌、尿路上皮細(xì)胞癌等晚期實(shí)體腫瘤,國內(nèi)暫無相同適應(yīng)癥的同類藥品獲批上市,米內(nèi)網(wǎng)MED2.0中國藥品審評(píng)數(shù)據(jù)庫數(shù)據(jù)顯示,目前兩個(gè)受理號(hào)均在審評(píng)審批中。
近日,該公司的1類新藥PZH2109膠囊申報(bào)臨床獲得CDE受理,該藥品主要用于治療非酒精性脂肪性肝炎(NASH)。公司已經(jīng)完成PZH2109膠囊原料藥以及制劑的藥學(xué)、藥理毒理、非臨床安全性評(píng)價(jià)等方面的研究,研究結(jié)果表明PZH2109膠囊具有良好的安全性、成藥性及臨床開發(fā)價(jià)值。截至目前,該藥品項(xiàng)目的研發(fā)投入累計(jì)約2,500萬元。
據(jù)悉,2020年3月saroglitazar magnesium藥物治療NASH獲得印度藥物管理局(DCGI)批準(zhǔn)上市,美國和中國暫無與本項(xiàng)目相同靶點(diǎn)相同適應(yīng)癥的藥品獲批上市。資料顯示,saroglitazar magnesium一種新型的過氧化物酶體增殖物活化受體(PPAR)激動(dòng)劑,該產(chǎn)品是世界上第一款獲批治療非肝硬化性NASH的藥物。
據(jù)公司年報(bào)數(shù)據(jù)顯示,2019年片仔癀研發(fā)投入接近1.2億元,同比增長18.47%,在研藥品品種11個(gè),涉及中藥、化藥創(chuàng)新藥及仿制藥,除了PZH2111、PZH2109外,治療廣泛性焦慮癥新藥PZH1204也值得期待。
來源:CDE官網(wǎng)、米內(nèi)網(wǎng)數(shù)據(jù)庫
審評(píng)數(shù)據(jù)統(tǒng)計(jì)截至2020年8月17日,如有錯(cuò)漏,敬請(qǐng)指正。



 110102000668(1)號(hào)
110102000668(1)號(hào)